蕾切尔·巴西发现,改变你基因开关的药物可能会改变我们治疗许多疾病的方式
药物研发正赶上表观遗传学。基因组的化学修饰不涉及底层DNA序列的改变,它提供了一个遗传控制系统,现在被认为是许多癌症、神经退行性疾病和免疫疾病的根源。化学家们现在正热切地追求表观遗传靶点和药物分子。新一代的此类药物正在研发中,看起来它们将能够使用各种创造性的策略治疗广泛的疾病。
表观遗传学描述了一种化学系统,生物学通过该系统控制基因蓝图在不同类型的细胞中如何使用——哪些基因被打开和关闭,因此哪些蛋白质被表达来制造,比如肝细胞或心脏细胞。最容易理解的表观遗传修饰是DNA甲基化,它主要发生在胞嘧啶碱基的C5位置。
甲基化胞嘧啶在整个基因组中都有发现,但在“基因启动子”区域中,甲基缺失,而转录(读取DNA代码以制造蛋白质的过程)就是在那里开始的。转录因子与DNA结合,基因被打开,但如果胞嘧啶甲基化,转录因子就不能工作,基因被关闭。
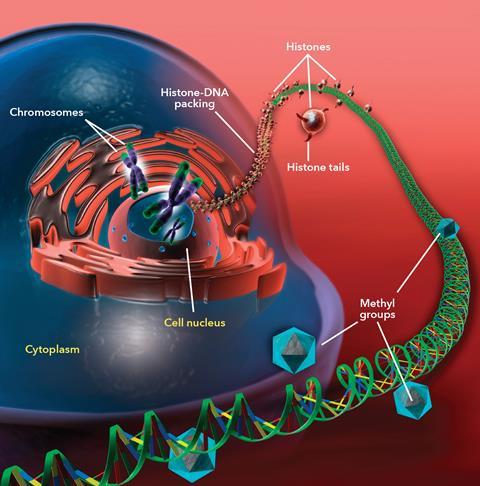
另一个众所周知的表观遗传过程涉及组蛋白——DNA包裹在组蛋白周围形成染色质的蛋白质,这种结构通常被描述为“绳子上的珠子”。如果组蛋白被化学修饰,通过在赖氨酸氨基酸上添加或去除乙酰基或甲基,染色质结构就会改变,影响基因的获取。
基因开关
表观遗传学控制着生物与环境相互作用的方式。想想蜜蜂:蜂巢里的所有蜜蜂都拥有相同的基因组,但喂食不同的食物,它们就会有不同的发育。那些以花蜜和花粉为食的幼虫会变成雄蜂或不育的雌性工蜂,但有一只幸运的幼虫会一直吃蜂王浆,变成蚁后。蜂王浆中含有的化合物能够阻止蜜蜂DNA中胞嘧啶碱基的甲基化,这些变化导致蜂王比工蜂大五倍。

到目前为止,表观遗传药物所解决的病症通常归因于不良饮食或吸烟等环境因素,这并非巧合。科学家们现在认为,癌症、糖尿病和阿尔茨海默病等疾病不仅依赖于遗传因素,还依赖于环境因素引起的表观遗传变化。这导致了新的药物靶点。英国帝国理工学院的药物化学家Matthew Fuchter说:“从理论上讲,由一整套不同的酶和调节过程驱动的表观遗传事件可以通过使用合适的小分子抑制剂来抑制甚至逆转。”
Fuchter的小组正在研究几种表观遗传方法,所有方法都是基于调节负责维持DNA和组蛋白上所谓表观遗传标记的酶。它们分为三类:“作者”,如DNA或组蛋白甲基转移酶,将甲基连接到DNA或组蛋白上;“擦除剂”,包括从组蛋白蛋白中去除乙酰基的组蛋白脱乙酰酶;或者是“解读者”,比如乙酰赖氨酸识别蛋白,它们与标记本身结合,促进基因表达。
从2000年代中期开始,第一批表观遗传癌症药物出现,目前有五种组蛋白去乙酰酶(HDAC)抑制剂和两种DNA甲基转移酶(DNAMT)抑制剂获批。“因为表观遗传目标是一个相对较新的类别,在确定可靠的起始点方面有相当多的挑战,”Fuchter说。另一个问题是,调节表观遗传途径的结果并不总是可预测的,因为生物学习惯建立冗余。“你可以把个体的表观遗传标记看作是基因表达调节中的层层包装。Fuchter解释说:“最重要的表观遗传目标并不总是立即显现出来。”“如果你抑制一个表观遗传目标,你不一定会看到预期的影响广度。然而,生物技术公司和大型制药公司正在开发越来越多的候选药物:2015年的一项估计显示,大约有90家公司正在针对50多个不同的目标开发100多种癌症表观遗传疗法。
英国牛津大学的药物化学家Paul Brennen正在使用化学探针寻找表观遗传药物。他认为他们对这个领域有很大的帮助。“因为我们从抑制剂中看到的并不总是你在生物学上预先预测的。“小分子探针可能不具有完全类似药物的特性,但它们与靶蛋白的相互作用可以帮助理解表观遗传标记和被打开或关闭的重点基因之间的关系。”这是用一种叫做ChIP- seq的技术完成的:染色质免疫沉淀(ChIP)使用附着在磁珠上的抗体沉淀出感兴趣的染色质蛋白,然后对伴随的DNA进行测序以识别基因。
HDAC抑制剂,迄今为止是表观遗传药物发现的主要焦点,增加染色质乙酰化水平,产生开放的染色质状态,导致先前沉默的基因的表达。这反过来会导致更正常的细胞周期和癌细胞死亡。第一代HDAC抑制剂缺乏选择性,倾向于针对大约18种HDAC酶的整个家族。它们的广泛作用会引起呕吐、免疫抑制和食欲不振等副作用。
“醒来后杀人”
现在,在设计上更具选择性的第二代药物正在研制中。总部位于美国剑桥的初创公司Epizyme也利用了癌细胞通常依赖表观遗传途径生存的特点。该公司成立8年,目前正在进行治疗多种癌症的临床试验,是一种组蛋白甲基转移酶EZH2的小分子抑制剂。
在某些癌症中似乎发生的是,突变的组蛋白甲基化酶针对错误的基因,导致癌细胞异常增殖。epizme的首席科学官罗伯特·科普兰(Robert Copeland)解释说:“我们的方法是寻找一种情况,这种情况下,一种途径被失调,导致癌细胞对特定组蛋白甲基转移酶的酶活性上瘾,而正常细胞不具有这种活性,因此抑制组蛋白甲基转移酶对癌细胞是致命的,但对正常细胞是良性的。”该抑制剂能够阻断特定的酶,但由于组蛋白甲基转移酶在正常细胞活动中发挥的作用可以忽略不计,因此有可能产生选择性影响,对非癌细胞的影响最小。
我们能够杀死那些癌细胞
罗伯特·科普兰
Copeland说,突变的EZH2酶在高达30%的非霍奇金淋巴瘤患者中被发现,但其他患者也可以从epizme正在设计的抑制剂类型中受益。有些癌症是由组蛋白甲基转移酶以外的蛋白质突变引起的,但仍然会导致基因打开或关闭;在这种状态下,细胞仍然依赖于组蛋白甲基转移酶途径来增殖。“我们已经看到,如果我们加入EZH2抑制剂,即使突变不在EZH2酶内,我们也能够杀死那些癌细胞,”科普兰补充说。
癌症仍然主导着表观遗传药物发现领域,但人们的注意力正转向更广泛的疾病群体。Fuchter正在研究表观遗传途径如何用于防治疟疾等寄生虫疾病——通过关注疟原虫自身的表观基因组。他说:“这种寄生虫就像人类一样,依赖于表观遗传事件来调节转录,因此你可以设计化合物来干扰寄生虫的表观遗传过程。”
治疗疟疾的一个重要问题是某些疟原虫能够在肝脏中保持休眠状态,不被发现并具有耐药性。在几个月或几年后的某个时刻,它将被激活,引起进一步的疟疾发作。但正如Fuchter解释的那样,“假设疟原虫的表观遗传过程可以控制寄生虫不同生命周期阶段的转录,因此这些靶点可能提供了使用传统抗寄生虫化合物不一定能获得的机会。”
2014年,Fuchter和一组国际合作者发现了疟原虫组蛋白甲基转移酶抑制剂,这种抑制剂不仅可以杀死血液期寄生虫,还可以“重新唤醒”休眠的肝脏期。然后可以用常见的抗疟疾药物来对付重新苏醒的寄生虫,这就是Fuchter所说的“唤醒并杀死”寄生虫联合疗法。
戒瘾
表观遗传药物提供的另一种可能性是能够用一次性有效重置表观基因组的药物治疗某些疾病。加拿大蒙特利尔麦吉尔大学的药理学家Moshe Szyf一直在测试这种治疗可卡因成瘾的方法。作为表观遗传学的先驱之一,Szyf已经在该领域工作了30多年,现在他的注意力转向了如何逆转瘾君子在戒断期间表观基因组发生的变化。这些会增加对毒品的渴望,并经常导致再次吸毒。多年来,研究人员一直在寻找导致成瘾的基因,但现在看来,表观遗传学可能发挥了重要作用。
Szyf和他来自以色列巴伊兰大学的合作者Gal Yadid首先研究了可卡因成瘾如何改变大鼠的DNA甲基化水平。他们发现,在停药期间——而不是在接触药物本身期间——DNA甲基化发生了最大的变化,数百个基因甲基化。为了阻止上瘾行为,Szyf试验了一种表观遗传药物——一种小分子DNA甲基化抑制剂:RG108。

在戒断可卡因30天后,研究人员对老鼠进行了测试,训练它们利用光或声音线索自我服用可卡因。上瘾的老鼠在接触到信号后会表现出强烈的药物寻求行为,但如果在动物接触信号之前注射药物RG108,上瘾就会永久停止——这表明一种单一的治疗方法重新编程了表观遗传标记,有效地“治愈”了毒瘾。Szyf说:“这让我们震惊,与许多其他用于治疗成瘾动物的药物治疗不同,你只做了一次治疗,它就消失了。”
“多年来,我们已经了解到,成瘾不是由一个基因引起的,而是由网络从一种状态到另一种状态的输出所引起的,所以医学的挑战不是开发一种特定的拮抗剂——在大多数情况下,这是徒劳的,因为网络有太多其他的方法来绕过它——而是重新编程网络。”我认为这就是这些药物至关重要的地方,”Szyf解释道。
表观遗传药物的另一种奇特效果已被证实——在这种情况下,用于治疗亨廷顿舞蹈病——一种致命的遗传性退行性疾病,会导致运动技能丧失和认知障碍。贝丝•托马斯美国加州斯克里普斯研究所的神经科学家,她一直在测试由她的同事合成的一系列更具选择性的HDAC抑制剂乔尔Gottesfeld.“她发现,这些药物不仅可以减轻小鼠的症状,延缓亨廷顿舞蹈症的发作,而且还可以改善接受药物治疗的小鼠的雄性后代,这些小鼠也携带亨廷顿舞蹈症基因。”
除了作为组蛋白去乙酰化抑制剂外,对小鼠大脑和肌肉样本的实验证实,甲基化变化也由这些药物引起,尤其是在y染色体上,这可能解释了为什么男性后代的甲基化改善最大。托马斯说:“这似乎是几种不同的表观遗传机制在起作用。”“人们知道DNA甲基化是一个稳定的标记,可以在基因组中遗传,所以我们提出了一个问题,我想知道这种效应是否可以遗传。”
遗传问题
遗传表观遗传标记的想法曾经是有争议的,因为人们认为基因组在胚胎发育之前就已经被清除干净了。现在很明显,事实并非如此,越来越多的证据表明,由饥荒等环境压力引起的表观遗传变化被延续了下来。1996年进行的一项研究分析了经历了1944年“饥饿冬天”的荷兰儿童,当时德国的封锁切断了他们6个月的食物供应。研究人员发现,这些人有大量增加的健康风险,如心血管和代谢疾病。但托马斯说,“并非所有事件都是有害的。”“我们的论文很有趣,因为我们发现(跨代)效应是有益的。”
鉴于表观遗传疗法正在改变我们的遗传密码的读取方式,有时还会遗传给下一代,我们是否应该更担心表观遗传药物的长期安全性?科普兰说:“就患者的安全性和耐受性而言,我们第一阶段的经验相当不错。”布伦南也同意,目前的安全测试足以发现问题。
但是,一种药物可能具有永久性的影响,并可以遗传给你的孩子,这一想法似乎令人担忧——尽管在某些遗传中,保护可能是有益的。但这不仅仅适用于表观遗传药物:人们在日常生活中所做的很多事情,包括吸烟和饮食,都有可能改变他们的表观基因组。
“表观遗传药物永远不应该用在孕妇身上,但我认为对其他成年人来说副作用很小,”Szyf说。但他承认,它们的相对安全性确实有违直觉。他说:“你可能会认为,如果你用一种药物来治疗一个病人,这种药物可以彻底改变DNA甲基化,你就会完全改变这个人——但这并没有发生。”他认为,这是因为很难改变一个细胞的潜在“真实程序”,因为所有的机械层都支持它。Szyf说:“我认为我们甲基化程序的稳健性很难改变,而经验上的附加功能则更容易改变,这就产生了选择性。”
那么,从表观遗传药物中,我们可以期待什么样的未来药物呢?例如,我们是否能够使用药物来逆转我们不良的生活方式选择对表观基因组造成的损害?我们知道,吸烟会导致吸烟者DNA甲基化水平的变化,而这些变化很可能在吸烟和癌症之间的联系中发挥了作用。那么,一种药物能重新编程吸烟者的表观基因组以消除患病风险吗?我们能不能继续吃汉堡和薯条,吃一颗药丸来逆转表观遗传损伤?
科普兰说,这当然是一种理论上的可能性。Fuchter说:“我们需要更好地了解所有不同的表观遗传修饰之间的相互作用,以及所有将它们联系起来的调控网络,才能有机会做到这样的事情。”我猜这在很长一段时间内都不可能实现。
雷切尔·巴西,英国伦敦科普作家











暂无评论