James Mitchell Crow探索了下一代治疗性生物材料,旨在与身体动态相互作用,帮助控制糖尿病和愈合伤口
本杰明·阿尔姆奎斯特想把生物材料带入四维空间。阿尔姆奎斯特的实验室位于英国伦敦帝国理工学院生物工程系,正在开发一种能与身体动态相互作用的材料,以促进伤口愈合。这只是医疗需求的一个领域,生物材料可以在变化的环境中对生化线索做出反应,这可能会对患者的结果产生很大的影响。
伤口修复就是一个很好的例子。这个复杂的多步骤过程包括不同类型的细胞波来杀死感染,清除受损细胞,然后形成新的组织。这个过程在很多地方都可能脱轨,结果包括慢性伤口无法愈合,以及形成过多的疤痕组织。
今天临床批准的促伤材料充其量是被动的参与者,例如控制释放材料,以预先编程的速度释放其治疗货物。阿尔姆奎斯特说:“这些材料实际上与伤口愈合过程中发生的事情没有相互作用。”“这就像跳舞,有人改变了音乐的节奏,但你仍然以原来的速度跳舞。”
控制血糖比听起来要复杂
阿尔姆奎斯特是越来越多的研究人员之一,他们希望开发出一种更灵活的材料,对周围发生的复杂生物过程的变化节律做出反应。
糖高点
一些长期寻求的智能生物材料旨在通过持续传感葡萄糖浓度并相应地释放定制的胰岛素剂量,自主地维持糖尿病患者的健康血糖水平。如果能够开发出一种智能、长寿、快速作用的血糖调节材料,全球4亿多糖尿病患者将直接受益。这项技术也可以成为智能材料的模型系统,根据特定的生物线索动态释放任何药物。
葡萄糖传感胰岛素释放生物材料在概念上可能很简单,但事实证明,要使化学工作正常,在技术上具有很高的挑战性。阿尔姆奎斯特说:“葡萄糖控制是一个非常大的领域,有很多工作要做,但葡萄糖控制比听起来要复杂得多。”“它必须持续不断地发生,每天都要发生,而且必须足够敏感和快速地做出反应。”
第一个例子是1979年开发的,基于一种叫做刀豆蛋白a (ConA)的葡萄糖结合植物蛋白。这种蛋白质被纳入含有胰岛素的多糖基质中。在游离葡萄糖的存在下,cona -葡萄糖结合会触发cona -多糖基质的解离,释放胰岛素。
该系统并没有成功投入使用,主要是因为ConA蛋白在受体中引发了免疫系统的副反应,但它为大多数尝试提供了总体蓝图。胰岛素被包裹在某种形式的基质中——通常是水凝胶——并通过化学葡萄糖识别事件释放出来。
水凝胶是交联亲水聚合物的三维网络,可以吸收大量的水。它们是构建活性生物材料的理想的生物相容性空白画布。“它们可以封装活细胞,它们可以封装各种生物活性和生物疗法——包括蛋白质,因为它们提供了一个保存蛋白质结构的环境,”美国西雅图华盛顿大学开发智能生物材料的科尔·德福里斯特(Cole DeForest)说。通过改变聚合物或将聚合物网络连接在一起的交联剂,它们可以根据各种生物信号释放出它们的货物。
在胰岛素释放的情况下,一种策略是使用随着pH值变化而塌陷或膨胀的水凝胶,并将葡萄糖氧化酶作为葡萄糖传感成分。葡萄糖氧化酶将糖转化为葡萄糖酸,降低pH值,从而触发水凝胶释放胰岛素。
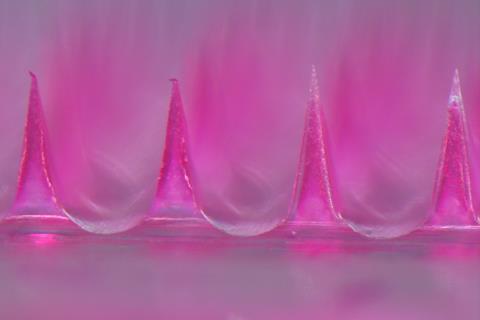
使用微针系统应该可以在人体范围内控制血糖水平
这些系统通常太慢,无法有效控制葡萄糖,特别是在体内ph缓冲环境中。但是另一种葡萄糖传感元件,苯基硼酸(PBA),看起来更有希望在生理条件下实际用于基于水凝胶的胰岛素释放。日本东京医科和牙科大学(Tokyo Medical and Dental University)生物材料工程师松本明(Akira Matsumoto)说:“人们知道葡萄糖和硼酸之间的相互作用已经有近100年了。”PBA在平衡反应中可逆地与葡萄糖结合,因此有可能充当打开和关闭胰岛素释放的开关。
松本是20世纪90年代一个团队的成员,该团队展示了一种基于苯硼酸的胰岛素释放水凝胶。在高葡萄糖浓度下,沿着水凝胶的两亲性丙烯酰胺聚合物主干的PBA侧链与葡萄糖结合,形成带电的、完全水合的状态,释放胰岛素。随着葡萄糖浓度的下降,与PBA结合的葡萄糖越来越少,水凝胶恢复到不带电状态并开始脱水。当葡萄糖浓度达到目标水平时,水凝胶表面会迅速形成一层皮肤,在几秒钟内停止胰岛素的释放。
经过多年的工作,微调参数,如丙烯酰胺主干中PBA单位的比例,该团队开发了一种在生理温度和pH值下工作的系统,并调整以保持葡萄糖浓度在正常水平内。1这种材料在动物模型中表现良好。松本说:“我们的系统在控制每日血糖波动方面非常出色。”“我们有非常灵敏的反应,10秒的反应就能维持一周。人们还没有这种技术,所以我们非常兴奋。”
通过使用导管和外部水凝胶储存罐,该材料使糖尿病小鼠的葡萄糖水平在三周内保持在可控范围内。此后,该团队在体重是小鼠10倍的大鼠身上也取得了类似的成功。最近,Matsumoto发表的结果显示,涂有水凝胶的微针贴片可以控制小鼠的葡萄糖水平一周。2“由于这是一个以扩散为基础的系统,我们面临的挑战是扩大它的规模,为更大的动物和人类增加设备的功率。”我们必须增加表面积或浓度梯度,”松本说。他补充说:“使用微针系统,应该可以达到人体尺寸。”该团队的下一个目标是使用他们的微针贴片在猪身上实现持续的葡萄糖控制,猪的体重与人类相似。
振奋人心的发展
美国宾夕法尼亚大学的Jason Burdick是治疗性智能水凝胶研究领域的先驱之一。第一代药物释放水凝胶,结合聚合物,如聚(α -羟基酯),在生理条件下对水解敏感,只能以预先设计的速率释放胶囊治疗。布尔迪克开发了一种水凝胶,其治疗释放速率是动态的,取决于特定酶的水平。
伯迪克说:“酶通常会随着疾病的发生而发生变化——例如,在心脏病发作后,基质金属蛋白酶(MMPs)在组织中大幅增加。”由于这些蛋白质降解酶水平的升高会对组织结构造成永久性损伤,因此一直在进行研究,试图开发MMP抑制剂。但由于脱靶的副作用,没有一种在人体上成功。
布尔迪克制定了一个更有针对性的策略。3.他说:“我们的方法是设计水凝胶,其中水凝胶网络中的交联由多肽组成,这些多肽会对MMP酶做出反应。”“这是一种‘随需应变’的方法,疾病引起的酶水平升高会释放抑制剂,阻止同类型酶的活性。”
在成功地在猪心脏病模型中测试了可注射的按需mmp靶向水凝胶后,Burdick和他的同事成立了一家衍生公司Prohibix,将这项技术转化为生物医学应用。布迪克说:“我们正在寻求心脏和其他疾病的应用。”我们希望它能应用于临床。”
合乎逻辑的方法
除了MMP之外,还有很多触发因素正在被探索。布尔迪克说:“光线非常有趣,因为你可以很好地控制光线的位置和时间。”“科罗拉多大学的克里斯蒂·安赛斯(Kristi Anseth)、佐治亚理工学院的安德烈斯·加西亚(Andres garcia)等团队在光响应水凝胶材料方面做了大量工作,他们允许光触发材料变化。”“交叉链接昊图公司-硝基苯酯在近紫外光365 nm的照射下,会发生酯键的光分裂。另外,交联剂可以结合二硫键,二硫键在通常与疾病相关的还原条件下裂解。
在西雅图,DeForest和他的团队正在将所有这些触发因素整合到同一种水凝胶中,以创造出利用可编程布尔逻辑的生物材料,从而对水凝胶的物质释放的时间和地点施加更严格的控制。4
我们可以独立地、顺序地控制它们的释放
德福里斯特说:“我们意识到,人们用来诱导这些物质反应、以‘局部’的方式释放治疗物质的大多数线索,都远非独一无二。”触发因素越不独特,材料产生脱靶效应的几率就越大,通过临床试验的几率就越低。“我们想,我们能否提出一种可概括的策略,不仅需要其中一个线索,还需要两个线索?”德福里斯特说。“即使每一个单独的线索对特定的地点都不是特别特定,但它们的组合可能比单独的任何一个都更具体。”
逻辑门使这种多线索敏感性成为可能,DeForest已经证明了这一点。一种水凝胶交联剂可以对单一线索(如MMP酶)做出反应,从而有效地发挥YES门的作用。如果mmp敏感基团与二巯基串联在一起,那么如果交联的任何一个裂解断开,交联就表现为“或”门。如果MMP敏感基和二硫醇基平行连接,在一个循环结构中,需要两个基团被裂解来破坏交联,这就是一个与门。
阿尔姆奎斯特说:“德福里斯特的研究小组已经取得了一些非常令人着迷的成果。”“他们的材料具有布尔逻辑功能,可以接受多种刺激,根据刺激的类型给出不同的输出。”
虽然逻辑门的想法并不是完全史无前例的,但DeForest一直在系统地制作和测试所有可能的逻辑门组合。他说:“我们试图实现的一个重大飞跃是使它完全模块化。”“我们并不是在开发一个单一的方案,而是一套设计标准,如果你遵循这些标准,你可以替代任何可降解的连杆,并得到一种对任何不同输入组合都有反应的材料。”
例如,为了靶向癌症,DeForest和他的团队开发了一种只有在基质金属蛋白酶存在时才释放其治疗货物的材料而且化学还原环境,这两种都是肿瘤的特征。“我们正在利用这两种线索来诱导治疗药物的传递,从而在局部杀死肿瘤细胞。”
最近,该团队开发了他们的逻辑门多线索概念,以生产一种含有三种不同蛋白质疗法的单一水凝胶,每种蛋白质疗法由一组不同的预编程线索释放。5“这些都是全长蛋白质,用这些连接剂进行了位点特异性修饰,所以我们可以独立地、顺序地控制它们的释放。”“该团队目前正在测试这些材料用于伤口愈合,他们的想法是,根据伤口恢复的不同阶段自然呈现的线索,依次释放蛋白质。”
到目前为止,该团队一直在使用易于表征的宏观凝胶,并对细胞培养进行了测试。“我们一直致力于在纳米凝胶配方中制定这些逻辑可降解系统,可以通过静脉注射给药。”“然后,研究小组可以在老鼠身上进行实验,以验证这一策略的有效性。”
伤口愈合
光可以为智能水凝胶基质提供精确的外部控制,但它有一些明显的局限性。DeForest正在研究红移化学物质,开发对波长较低的光敏感的连接器,可以进一步渗透到身体内部。他说:“在电子工程方面,光遗传学社区也有创新,使用光纤在特定时间传递特定波长的光。”即便如此,光可能对研究有用,但不适用于医疗用途。“实际上,当我们考虑尝试制造一种与人类治疗相关的材料时,我们认为光只是一种模型输入。我们正在努力改变这种情况,将材料用于人体深处。”
在帝国理工学院,阿尔姆奎斯特还在寻找方法,摆脱光等外源性触发因素,利用身体已经在使用的更自然的线索来协调伤口愈合等复杂过程。阿尔姆奎斯特说:“我们关注自然系统,看看它们是如何运作的,看看我们是否能概括出其中的一些行为。”
阿尔姆奎斯特开发了一个能对物理线索做出反应的系统。6在伤口愈合过程中,一种名为TGF-b的生长因子与新铺设的称为细胞外基质(ECM)的组织支架一起被铺设。阿尔姆奎斯特说:“这种支架很软,但在伤口愈合过程中会变得越来越硬。”被称为肌成纤维细胞的细胞拉动ECM使其变硬。一旦足够坚硬,肌成纤维细胞就能抓住TGF-ß包裹的蛋白质笼子,释放并激活生长因子。阿尔姆奎斯特说:“这建立了一个前馈循环,告诉进行基质重塑的细胞进行更多的改造。”收缩的ECM闭合了伤口。
利用牵引力来释放生长因子是一种仅在伤口愈合中发现的独特线索,也是一种智能生物材料可以用来帮助促进愈合的独特触发器。阿尔姆奎斯特表示,以这种方式利用牵引力的诀窍是使用被称为适体的短的化学合成单链DNA。这些可以通过定向进化技术进行调整,折叠成特定的3D形状以绑定到目标基板上。“当它们被折叠起来时,它们可以放入蛋白质的结合袋中。但如果你把它们弄直,它们就会失去所有的粘合性,”阿尔姆奎斯特说。
该团队开发了一系列能够识别不同生长因子的适体,并将每个适体的一端固定在胶原蛋白底物上。在另一个容器上,他们将目标细胞类型能够识别、抓住并拉动的细胞黏附肽附着在容器上。当细胞施加牵引力时,适体解开,其生长因子货物被释放。该团队称他们的发明为牵引力激活有效载荷(陷阱)。
阿尔姆奎斯特说:“这是第一个利用牵引力释放治疗物质的工程系统。”“我们的研究表明,如果你把适体的手柄改变成只有某些细胞才能识别的东西,你就可以让不同的细胞释放不同的蛋白质。”该团队目前正在寻找使用Traps来指导细胞行为的方法。“在伤口愈合过程中,某些细胞到达,另一些细胞离开。现在我们可以设计出一种材料,只要有合适的细胞存在,这些信号就会被激活。”
作为合成结构,不仅仅是Trap的细胞结合端可以被改变。它们可以锚定在许多不同的基板材料上。“我们正在研究类似3D打印的东西,在三维空间上打印不同分子的不同陷阱。”“通过控制生长因子释放的时间和空间,打印出来的基质可以指导特定区域的细胞向何处移动。”
一种可能性是,陷阱可以用来帮助协调不同免疫细胞类型的进出,这些细胞类型是伤口修复不同阶段的关键。阿尔姆奎斯特说:“人们对如何利用免疫系统调节伤口修复很感兴趣。”“如果你观察像蝾螈这样的再生生物,它们总是有免疫细胞在那里进行这个过程。“通过诱导特定类型的免疫细胞更早到达或更快离开,有可能开始塑造伤口修复和减少疤痕。”
最初,能够在伤口修复过程中影响免疫细胞的到达和离开将是一个有用的研究工具,可以更详细地了解伤口愈合过程以及它是如何形成的。任何来自这项工作的见解都应该直接转化为临床应用。阿尔姆奎斯特说:“基于适配体的平台的动机之一是有临床批准的适配体,所以有一条途径,一个生态系统来制造这些适配体并将它们推向临床。”
阿尔姆奎斯特说:“进入第四维度,设计这些动态系统,可以随时间对组织产生双向反应——这似乎真的是下一代生物材料。”
詹姆斯·米切尔·克罗是澳大利亚墨尔本的科学作家
参考文献
1松本A等,科学。睡觉。, 2017,3., eaaq0723 (DOI:10.1126 / sciadv.aaq0723)
2 S陈等,ACS Biomater。科学。Eng。, 2019,5, 5781 (doi:10.1021 / acsbiomaterials.9b00532)
珀塞尔等,Nat。板牙。, 2014,13, 653 (doi:10.1038 / nmat3922)
4 B A巴都等,Nat,化学。, 2018,10, 251 (doi:10.1038 / nchem.2917)
下午5点,高华德等,放置板牙。, 2019,31, 1902462 (doi:10.1002 / adma.201902462)
6 A Stejskalová等,放置板牙。, 2019,31, 1806380 (doi:10.1002 / adma.201806380)













暂无评论