俄罗斯的研究人员修正了电负性基本概念的公式这使得它在预测化学的其他方面更有用。Artem Oganov和莫斯科斯科尔科沃科学技术研究所的克里斯蒂安·坦塔尔迪尼对莱纳斯·鲍林在1932年最初设计的方程做了一个看似简单的改变。新的公式更好地反映了反应是释放能量还是吸收能量,并避免了原来对含金属模块做出的奇怪预测。
“电负性可能是元素最重要的化学性质,”奥加诺夫说。它表示在一个化学键中,原子间的电子分配是均匀的还是不均匀的。因此,这一概念经常解释热力学定律允许哪些化学反应起作用。但鲍林的定义有时并不能很好地代表现实。奥加诺夫说:“看看鲍林电负性,你会发现在硼化钼或氢化钨中,金属原子应该带负电,非金属原子应该带正电,这对化学直觉来说是不可思议的。”“我们的规模纠正了这个问题。”
奥加诺夫一直在定义元素在高压下的电负性,以帮助解释在这种条件下发生的奇异化学现象。他让他的博士生坦塔迪尼检查他们的计算方法是否能在零压力下产生原子的电负性。奥加诺夫说:“让我们惊讶的是,你无法调和键能,无论是计算的还是实验的,以及鲍林电负性的值。”“当电负性差很大时,鲍林公式就不再适用了。换句话说,它所描述的影响最大、最需要它的地方并不能准确地发挥作用。”
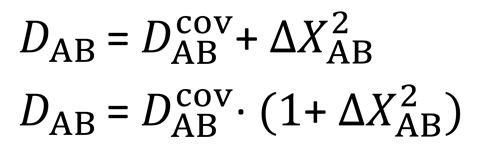
在鲍林方程中,化学键的能量是共价项和离子项的和。离子项是键合原子的电负性之差的平方。这是可能的最简单的公式,但有明显的问题。例如,在比较氟化锂和氟化铯时,锂和氟之间的键更短、更强。这意味着氟化锂的共价项和离子项比氟化铯大。奥加诺夫说:“根据鲍林公式,人们应该得出结论,铯的电负性比锂强,这与化学直觉相矛盾。”
加强鲍林
其他研究人员试图解决这个问题,他们使用了更复杂的公式,并取得了一定的成功。然而,Oganov说,从键能中获得电负性的公式仍然与从电负性中获得键能的公式不兼容。他说,他和坦塔迪尼因此“提出了消除这些问题的最简单的可能公式”。他们改变了方程,使得电负性差的平方不再直接等于键能的离子部分。它表示离子和共价部分的比例。
奥加诺夫说:“事实上,这更符合鲍林最初的观点,即由于离子和共价波函数的共振,键的稳定。”它还有一个额外的好处,即所得到的电负性不是用任何测量单位来量化的,而鲍林公式有奇怪的eV单位−1/2.
佩德罗萨尔瓦多西班牙赫罗纳大学的一名研究人员指出,鲍林从实验数据中推导出了他的方程,而不是一个潜在的物理模型。他说,新的公式因此是“合理的”,而且表现更好。然而,他补充说,今天的计算化学可以在没有电负性的情况下高精度地预测反应能。萨尔瓦多说,如果是在鲍林的时代,这将产生更大的影响。
奥加诺夫说,总的来说,科学家们对新公式的反应是积极的。他补充说,鲍林关于电负性的直观概念仍然“非常有用”。奥加诺夫说:“他确实是一个天才,我们的工作并没有摧毁他的想法,而是修改和加强了他的想法。”
更正:佩德罗·萨尔瓦多的隶属关系于2021年4月14日更新。
参考文献
C Tantardini和A R Oganov,Commun Nat。, 2021, doi:10.1038 / s41467 - 021 - 22429 - 0











暂无评论