化合物可能会导致短期的副作用,但不太可能背后极其罕见的凝血事件
德国的研究人员报告大量的人类,在阿斯利康的冠状病毒疫苗病毒蛋白质。尽管该研究尚未同行评议,这表明这些杂质可能是与许多人的强烈反应注射后两到三天。预印本也指出,可想而知,尽管怀疑,这些蛋白质可能与罕见的凝血事件。
阿斯利康的疫苗包含一个黑猩猩腺病毒基因工程,以避免其复制,而是使Covid峰值蛋白质在人们接受注射。人类蛋白质杂质——主要是热休克蛋白质和细胞支架——来自人类的肾脏细胞株用于生成黑猩猩腺病毒。病毒在复制的病毒蛋白质重要生产国细胞也存在。
这项研究的首席研究员,Stefan Kochanek乌尔姆大学说,他惊讶于大量的蛋白质质谱探测到在三个疫苗。至少一半的蛋白质存在于人类起源的疫苗,”Kochanek说。很多关于12.5μg包含病毒的疫苗之一一剂和22μg non-virus蛋白质。
腺病毒载体是通过破坏培养的哺乳动物细胞感染病毒,然后病毒纯化。“如果过程不是超级完美,那么你最终得到的我们看到:从生产细胞蛋白质的存在,这就是为什么我们称之为流程相关杂质,“Kochanek解释道。
热休克蛋白可以刺激免疫系统蛋白质绑定和交付到其他免疫细胞。他们原则上可以增强免疫反应对任何他们结合,“Kochanek说。虽然他怀疑他们造成的罕见的凝血事件,他说,这是一个可能性。
“证据表明,留在阿斯利康的蛋白质疫苗安全水平,这是类似于其他疫苗或低于水平产生了以类似的方式,”阿斯利康送到在一份声明中说必威体育 红利账户。“没有证据表明(蛋白质)是免疫原性。之间的连接蛋白质和血栓形成和血小板减少症的发生提出,没有实验证据支持这一点。
专家们研究结果的意义。,有少量的病毒的细胞碎片和一些组件用于种植病毒并不意外,“说丹尼尔Bracewell来自英国伦敦大学学院的研究宿主细胞蛋白单克隆抗体生产过程。他是持怀疑态度的链接与血栓形成综合征,描述这是投机。
Bracewell惊奇地发现,很多之间的变化。一致性这可能反映了一个问题,是关于如果漂移范围以外的临床试验材料,”他说。尽管如此,他说,阿斯利康和监管机构必然已经讨论了蛋白质等杂质并同意可以接受的水平。
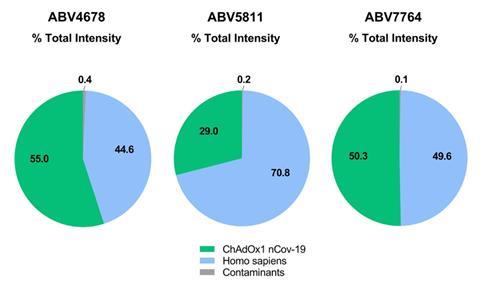
免疫学家Hildegund Ertl在费城的威斯塔研究所,美国说,美国食品和药物管理局将允许这种蛋白质存在,通常在毫微克/剂量范围。但阿斯利康疫苗在微克范围,所以很高”,她说。
Ertl说还有待证明如果杂质是导致罕见的血栓形成综合征,描述这是一个假设。“这仍然是一个非常好的疫苗,”Ertl补充道。“我并不是说人们不应该。”她是至关重要的一些负面新闻报道的疫苗已经收到了她的家乡德国。
Ertl指出,强生腺病毒疫苗与血栓性副作用较少,而这些似乎没有其他腺病毒疫苗,人造卫星诉她不禁怀疑这可能是净化过程。如果有净化问题,他们并不难解决,“Ertl说,现在从事艾滋病毒和腺病毒疫苗与人造卫星V无偿咨询作用。
然而,Bracewell警告说,阿斯利康不能明显改变其净化过程,至少在某种程度上改变了疫苗。“不管你得到批准,这是你需要做的。你不能做任何事情来让它纯净(从临床试验中使用的是什么),”他说。此外,一些哺乳动物细胞的杂质可能会提高免疫力的辅助效果,他说。
Andreas Greinacher医生和血小板障碍专家格赖夫斯瓦尔德大学在德国,不同意调用细胞和病毒蛋白的杂质,倾向于术语“疫苗成分”。尽管如此,Bracewell说官方术语描述了它们作为杂质,以净化控制技术水平可以接受监管机构。他承认这个词“杂质”的共鸣,消极的含义,但这不同于污染物,必须完全缺席的疫苗。
公司发展和验证质量控制测试测量蛋白质符合行业标准,“阿斯利康在一份声明中解释道。每批测试前批释放一个条件或紧急使用批准。”
罕见的凝血事件变得明显时年轻的医务工作者,主要是女性,开始接种疫苗在欧洲,Greinacher指出。的血栓形成健康的20 -和30-something-year-old女性极低,这使治疗医生非常怀疑当他们第一次遇到它,”他说。
但Greinacher也在尽力强调这种副作用非常罕见和接种疫苗的好处说意味着没有人应该避免阿斯利康疫苗。他计划分析强生公司阿斯利康疫苗疫苗和比较结果。
引用
L Krutzke等,研究方,2021,DOI:10.21203 / rs.3.rs - 477964 / v1











1读者的评论