新结构的研究可以帮助设计师打击艾滋病的疫苗,这很伤我的心
新的研究有助于解释为什么旨在解除HIV抗体不工作,除非他们在达到他们的目标。
研究表明,抗体可以变得无用如果目标只有一个原子的宽度,提供一个洞察疫苗设计者面临的困难。
艾滋病毒是众所周知的能力给抗体滑——只有少数表现出任何有用的活动程度对抗病毒。那些是数着罕见的b12抗体,它提供一定程度的保护自然在人的免疫系统产生。艾滋病疫苗研究是集中在网站,b12结合糖蛋白(gp120)病毒飙升,使它进入免疫细胞。
在这项新研究中,美国研究人员分析了晶体结构的b12和其他
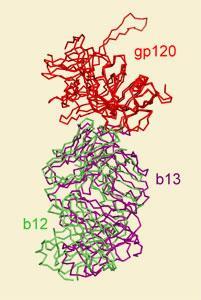
少有效的抗体,与糖蛋白本身复杂,针对展示微妙的变化可以使那些中和的区别和那些不。根据Gary Nabel说,报告的作者之一在美国国立卫生研究院疫苗研究中心的贝塞斯达,马里兰州,绑定交互是几乎一样的。结构研究中我们可以看到的是,在特定的抗体,这有点从b12结合的方式,”他说。“这是几? ngstr吗?女士和角度略有不同。”
至关重要的是,这轻微的mistargeting导致non-neutralising抗体无法识别糖蛋白的形式接受艾滋病毒——不像单身自由的蛋白质晶体结构,显示gp120的病毒三聚物的。自由单体的g120在感染和脱落,事实上,充当诱饵non-neutralising抗体。联合表示,他的研究提供的机会之窗使研究人员能够模型中什么是重要的在三聚物为了找到方法的角度抗体需要识别和消灭它。
没有这些信息就像试图找到控制开关关掉所有的灯,在电视机的联合表示。“你可能到达那里如果你知道房间在黑暗中,但亮灯的时候你可以去你要去的地方没有任何犹豫。
克里斯·斯坎兰参与艾滋病疫苗设计牛津大学,英国表示,这项研究是一个重要的步骤。“这对我们来说是非常有趣的在地里干活,因为它告诉如何设计一个疫苗,”他说。它告诉我们这是没有好针对你刚刚改变了残留单体,因为所有会发生的是你会得到更多的non-neutralising抗体而不是好的像b12抗体。”
海莉桦木
引用
L陈et al,科学,2009年,DOI: 10.1126 / science.1175868









还没有评论