荧光蛋白探针可以照射细胞的内部运作,但让他们需要努力和运气,安迪Extance发现
荧光蛋白可以照射细胞的内部运作,但让他们需要努力和运气,安迪Extance发现
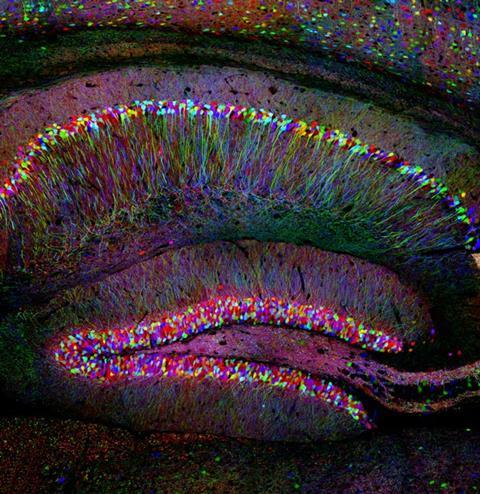
当乔舒亚•赛恩斯转基因小鼠交配与红色与绿色的荧光到另一个神经元,它与大脑产生超过一窝小狗俗丽辉光。哈佛大学研究员Sanes——在美国,不只是看到绿色和红色神经元,一些生产这两个颜色,因此出现黄色,给博士后琼Livet一个主意。他意识到细胞可以产生多个不同程度的颜色,混合生产之间的颜色。“天才之举”,根据Sanes——,是在使用马赛克效应使它更容易标签和学习否则细胞区别开来。Livet Sanes——“团队首次出版系统,故意转基因的优化版本效应在2007年老鼠神经元,配音技巧的大脑彩虹”。1
这是一个引人注目的例子,研究人员试图利用荧光蛋白结构关注细胞做什么。自1962年独立以来,绿色荧光蛋白(GFP)的发光水母Aequorea victoria照亮许多生物以其怪异的色彩。然而,尽管赢得荧光蛋白质2008年诺贝尔化学奖寻求报道的,最先进的荧光探针生物、生物化学和生物物理活动微弱的成功。Sanes——承认,甚至大脑彩虹的原始版本,目前第三代,“可能是更容易使用比我们会喜欢的。但由于持续努力,蛋白探针今天越来越多地设置一个光辉的榜样,经常在Livet和Sanes——的情况下,从机会——一个大的贡献。
大脑彩虹插入遗传指令让三个或四个不同颜色荧光蛋白为一个特定的细胞类型。每个单元随机变化每个蛋白质的数量,使意义产生大约100种颜色。大脑彩虹因此适合长,薄的神经元细胞,Sanes——解释道。如果神经元去不同的地方,你可以跟他们每个人,”他说,这种方法有助于展示视觉系统连接,例如。另一个常见用法是在细胞分裂看着动物生长。说你有17细胞17个不同的颜色,和等待,直到你有1700个细胞,他们还是会只有17个不同的颜色,“Sanes——说。通过观察,你学习了很多关于发展。”
现在许多实验室使用大脑彩虹成功,这在一定程度上要归功于他的团队是如何解决着色游戏。特别是,大脑彩虹的第一个版本是在许多情况下,坦白说不够亮的。“因为你使用不同的颜色是每个颜色少一点明亮,“Sanes——解释道。解决这个问题是有可能的,因为绿色荧光蛋白的发现引发了哈佛研究人员所说的“革命”,揭示了各种可能的荧光蛋白。虽然他的团队可以选择最亮的可用的它仍然是很高兴有光明的蛋白质”,他说。
红色警报
其他科学家正试图帮助。对许多人来说,首要目标是三个238个氨基酸的GFP自发反应形成two-ring发色团的氧气。其余的蛋白质形成barrel-like形状在一个线程携带三个关键氨基酸,有利于荧光发色团形成的安排。结构是破译二十年以来,研究人员让小突变基因编码,告诉有机体产生的蛋白质。等的结果努力改变GFP的光谱特性,Sanes——强调,他的团队也受益于其他团体寻找蛋白质荧光生物。
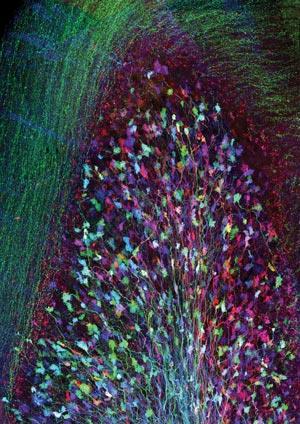
Red-emitting荧光蛋白等蛋白质一直推崇的目标工程师和猎人。在显微镜下,活组织吸收和散射红光小于其他颜色,和红色光危害和激发的荧光组织更少。然而,相比于今天提供的绿色最好的增强型GFP,现有的深红色蛋白质通常是昏暗的,更容易被光分解。甚至在蛋白质与其他生物具有相同的一般和GFP桶的形状,其发色团环往往更容易形成。
乌尔里希Nienhaus在德国卡尔斯鲁厄理工学院的那些因此追求新的、改进的替代方案。在一起Jorg Wiedenmann来自南安普顿大学的在英国,Nienhaus发现bubble-tip海葵Entacmaea quadricolor四个相同的蛋白质分子聚集在一起,产生红色荧光。然而,这样tetramer-forming序列可能导致不必要的聚合时添加到其他蛋白质,对科学家们想要研究函数。
产生一个更有用的蛋白质、Nienhaus Wiedenmann和他们的同事们经历了一系列的突变。首先,他们产生一个明亮的red-emitting非聚合单体的蛋白质,mRuby。从他们发达mGarnet,其亮度是类似于其他红色荧光蛋白,但仍不如GFP。2当暴露在光虽然很稳定,这是另一个曾获诺贝尔奖的技术显得尤为重要,这一次2014年的受激发射损耗(发生的)超分辨率显微镜。提供图像的最小尺度,、使用聚焦激光束,可以激发荧光蛋白,和第二个圆环形激光淬灭荧光在第一位置的边缘。扫描光束穿过样品建立一个高分辨率的画面。这意味着蛋白质激动和多次淬火,反过来,他们的韧性是至关重要的。
氨基酸序列之间的差异mGarnet mRuby只是四残留物,然而研究人员不得不生产超过300种不同的突变体来发现它。我们没有太多的控制,Nienhaus承认。这是试验和错误。我们正在努力修改的东西已经被证明是成功的其他荧光蛋白,但这可能完全失败。我们仍然不了解蛋白质支架和发色团之间的相互作用,能够预测这样的结果合理的工程方法。
输入电压
财富这样一个突出的作用是普遍的进步蛋白探针科学家用来研究细胞。另一个例子是一个细胞内蛋白质传感器,检测电压,通过其荧光强度报告他们的阅读。直到2012年,最好的这样的系统提供的荧光变化太小,响应时间太慢容易利用。
生物传感器的电压现在才开始好是有用的
劳伦斯•科恩
尽管如此,Lei金在美国耶鲁大学的寻求工程师到细胞系她可以可靠地生长在实验室研究使用不同的荧光蛋白的影响。她不仅成功,但voltage-driven荧光变化产生的细胞至少五倍曾经见过的。3改善了由于一个幸运的自发突变的细胞系,解释道劳伦斯•科恩领导集团金工作。他希望新的传感器,称为电弧光,将帮助科学家测量电势一些重要的生物学过程的核心无需电极。
你可以看到摄像头的潜力,在许多细胞,很难用一个电极,”科恩说。你可以做得更好在心脏和大脑的测量活动。特殊的蛋白质电压传感器是可以让他们出现在特定的细胞类型。例如,在视网膜上,大约有100种不同的细胞类型。如果你想找出单个细胞参与蛋白质生成一个输出,那么你需要一个传感器可以出现在每一个细胞类型,一次一个,而不是一个有机染料,每一个细胞被激活并将它绑定”。
由于电弧光等的进步,生物传感器的电压现在才开始好是有用的应用程序,根据科恩。但他补充说,“直到最近,没有人有任何想法”电压如何影响蛋白质的荧光,因此进一步改善目前构成了重大挑战。
离子出缺陷
然而正是这样的改进艾米·帕尔默美国科罗拉多大学的希望。“仍有大量的传感器不被广泛使用,可能是因为他们不够健壮的非专家,”她解释说。
几个著名的成功案例已经出现从优化努力,帕默强调。她认为最成功的是单身fluorescent-protein-based钙传感器称为GCaMP,优化其本人是该园由霍华德·休斯医学研究所的研究人员维吉尼亚州的校园。最初开发使用组件包括GFP和钙结合蛋白钙调蛋白在2001年,GCaMP现在在其第六代。4结合蛋白是黑暗当钙缺失,并会发出荧光的礼物。
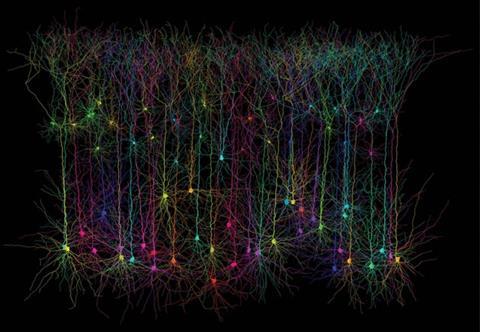
这些传感器现在非常强劲,为大量的研究工作,”Palmer说。GCaMP特别有用在监视事件像分子结合蛋白质在细胞表面,引起暂时的瞬态细胞内钙离子浓度的变化,她补充道。这些改进是努力的结果优化信号,提高稳定性,并确保传感器将函数在不同的生物模型。
GCaMP衡量对帕默的团队测试蛋白质钙传感器的发展。两个荧光蛋白可以直接通过荧光共振能量转移(Fret)当他们接近在一起,一个匹配的发射光谱激发光谱。外加一个ion-sensing部分的蛋白质,这样可以报告对浓度变化。钙离子结合,为传感器蛋白质的构象变化,增加能量转移,使蛋白质接收能量发出荧光明亮。
“烦恼传感器可以用来量化细胞内分子和离子,”帕尔默解释说。以及钙,她的团队也在研究锌离子显示器,使用青色和黄色荧光蛋白。5我们和其他人提供了整套的多个传感器,”她补充道。这些导致了稳健估计的锌在细胞胞浆和新假设细胞如何使用和调节锌。
这可能有助于扩展发现细胞内金属离子的变化定义和可衡量的方式针对不同的刺激,帕默说。例如,当一个卵母细胞-卵细胞受精的精子,钙信号发生,”她说。与每一个从卵母细胞钙信号锌释放。现在还不清楚,锌在做什么,但很引人注目,所以社区现在专注于如何解码这些动力学。
让机会
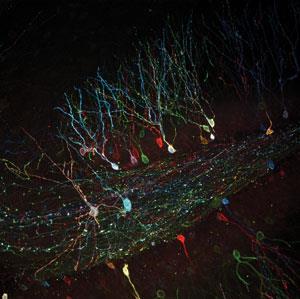
帕默的工作依赖于高通量方法既全面形象的各种细胞反应和设计新的传感器系统。在未来,她热衷于使用此方法来提高荧光蛋白的生物物理属性,包括状态之间的切换。“如果我们可以找出控制切换时间或大小,我们也许能够优化不同的应用程序,”她说。
荧光蛋白的原型之间切换颜色源自另一个意外的发生率,据Yoshikazu Imanishi来自美国俄亥俄州凯斯西储大学的。他解释了Atsushi Miyawaki的团队在埼玉县的日本,日本试图描述一种新的绿色荧光蛋白从石珊瑚,Trachyphyllia geoffroyi。6他们离开这绿色荧光蛋白在板凳上,第二天他们发现它已经从绿到红,“Imanishi说。“他们决定称之为枫,这意味着枫叶在日本,枫叶也将从绿色到红色。
枫的颜色变化是由紫外线引起的,因此称为photoconvertible蛋白质,更多的已经被开发出来。Imanishi的团队添加这种探针组特定基因工程动物蛋白质,并跟踪他们的行为在特定的细胞。一种可能性是观察蛋白质后会发生什么变化。我们可以在细胞中所有的蛋白质转化成红色,然后所有新产生的蛋白质是绿色的,所以我们可以很容易地想象他们,”他说。
显微镜是300岁,但有大量的发展在过去的六年
劳伦斯•科恩
这样西方科学家这看蛋白质移动,和测试肌动蛋白是否参与携带关键蛋白质在细胞周围。7的肌动蛋白是一种高速公路汽车运输小泡膜蛋白包含蛋白质,“Imanishi说。我们摧毁了肌动蛋白丝化学和监视的运输循环GMP-gated受体通道和g蛋白耦合。我们发现g蛋白耦合的受体可以去特殊膜室应该是,但循环GMP-gated渠道不能去等离子体膜。传输机制依赖肌动蛋白,但另一个不是。”
可转换荧光蛋白使另外2014化学曾获诺贝尔奖的超分辨率显微镜方法,使光敏化本地化显微镜(Palm)。方法可以使用绿色荧光蛋白可以翻去,例如,或不可逆转地激活。“想象单一荧光蛋白需要少量的蛋白质,因为如果两个荧光蛋白聚集他们很难解决,“Imanishi说。的想法是激活荧光蛋白在非常少量多次的方式重建许多单个分子的分布在分辨率衍射极限以下。
参与现代显微技术拟合,考虑到科恩引用了历史超分辨率的情况下,预测蛋白质传感器未来的可能。显微镜是300岁,但有大量的发展在过去的六年里,”他说。如果你投入努力,他们可以更好的东西——这是一个普遍的事情。人们将付出努力使蛋白质传感器,在很长一段时间他们会变得更好。我希望蛋白质传感器发展会持续几个世纪。
安迪Extance英国埃克塞特是一个基于科学作家吗
引用
1J Livet等,自然,2007,450年56 (DOI:10.1038 / nature06293)
2一个Hense等,科学。代表。,2015,5,18006 (DOI:10.1038 / srep18006)
3L金等,神经元,2012,75年,779 (DOI:10.1016 / j.neuron.2012.06.040)
4线性调频陈等,自然,2013,499年,295 (DOI:10.1038 / nature12354)
5H马等,j。化学。Soc。,2012,134年,2488 (DOI:10.1021 / ja2101592)
6R安藤等,Proc。《科学。美国,2002,99年,12651 (DOI:10.1073 / pnas.202320599)
7我Nemet等,j . >。,2014,34,8164 (DOI:10.1523 / neurosci.1282 - 14.2014)









还没有评论