人类免疫缺陷病毒——今天更广为人知的是HIV——在20世纪80年代初首次被发现,然而到1995年,一种新的抗逆转录病毒(ARV)药物开始帮助患者。每一种抗逆转录病毒疗法都针对病毒的一个生命阶段。不同药物的组合可以控制病毒,帮助避免耐药性。有四大类几十种抗逆转录病毒药物可以阻止病毒复制,艾滋病毒患者现在可以通过服用抗逆转录病毒药物组合,过着相对长寿和健康的生活,这是医学科学的一项惊人成就。
“在过去的20年里,艾滋病治疗发生了革命性的变化。它把艾滋病毒从死刑变成了可控制的慢性病,”他说安德鲁欧文他是英国利物浦大学的药理学家。缺点是患者必须每天服用抗逆转录病毒药物。
目前的药物治疗方案对患者来说并不容易。必须服用多种抗逆转录病毒药物。许多药物的吸收率很低,所以药片的大小可以弥补损失。有些是800毫克片剂,是名副其实的大口吃药。欧文解释说:“有些药物只有40%被血液吸收,所以你必须给很大的剂量。”由于患者必须每天服药,药物疲劳会出现,患者会过“药物假期”,这让病毒得以反弹。
欧文正在和他的利物浦队友一起努力缓解这种情况史蒂夫Rannard他是一位聚合物化学家。他们的方法制造药物纳米颗粒,增加了活性物质的表面质量比,从而增加了体内的吸收。这使得剂量最多可减少50%。欧文说:“减少剂量意味着你可以更灵活地在一片药片里放入更多的药物。”减少活性成分也可以降低成本,可能高达50%。
抗逆转录病毒药物非常有效,但问题是它们不能治愈
利物浦的研究小组用抗逆转录病毒生成了一种溶液,这种溶液可以冷冻干燥,制成固体纳米颗粒给病人服用。该团队已经开始在英国伦敦切尔西和威斯敏斯特医院对艾滋病患者进行首次人体试验,使用两种抗逆转录病毒药物:依非韦伦和洛匹那韦。兰纳德说:“我们已经使用喷雾干燥来模拟冷冻干燥的过程,这在工业上是可扩展的,使我们能够制造出临床相关的材料。”他们还与瑞士日内瓦的药物专利库合作,将其知识产权授权给一家制药公司,以便在中低收入国家提供更有效的药物组合。他们的目标是将更便宜、负担更轻的抗逆转录病毒药物以纳米颗粒的形式输送到患者体内。
Crispr能拯救我们吗?
除了改进抗逆转录病毒药物来控制艾滋病毒外,研究人员目前还在寻求新的治疗策略,其中许多策略要么用基因切片机攻击病毒,要么改善患者的免疫系统。
“抗逆转录病毒药物非常有效,但问题是它们不能治愈,”他说布莱恩·卡伦他是美国杜伦杜克大学的病毒学家。“它们能抑制病毒,但一旦你停药,病毒载量就会恢复到用药前的水平。”“艾滋病毒是一种游离形式的RNA病毒:它在与一种叫做CD4的表面糖蛋白(以及一种共受体CCR5)结合后进入宿主T细胞。”一旦进入细胞,逆转录酶将病毒RNA转化为DNA。HIV DNA进入细胞核并插入患者自身的DNA中。目前没有任何一种疗法可以处理这些储存的HIV病毒。
处理潜伏的HIV病毒可以治愈病人。一种方法是将基因编辑器Crispr引入细胞,其蛋白质Cas9靶向HIV DNA的特定序列。“如果你让Crispr-Cas靶向并去除HIV DNA,你就可以治愈受感染的细胞。从理论上讲,这是非常简单的陈梁他是加拿大蒙特利尔麦吉尔大学的病毒学家。日本的一个研究小组在用慢病毒内传递的Crispr-Cas9靶向其调控基因后,也抑制了HIV-1在白细胞(称为t细胞)中的复制。1
卡伦说:“我们和其他研究小组已经证明,使用Crispr-Cas技术可以很容易地治愈组织培养板中感染HIV-1的细胞,甚至可以摧毁细胞内的所有潜在副本。”一个由卡迈勒哈利利的天普大学的研究人员使用Crispr-Cas9技术,从移植了人类免疫细胞并感染了该病毒的活小鼠中切割出HIV DNA。2卡伦认为,这一策略同样可以有效地对抗人类艾滋病毒。但要想奏效,首先你必须找到潜伏感染的细胞。据估计,百万分之一的t细胞是沉默的艾滋病毒避难所。
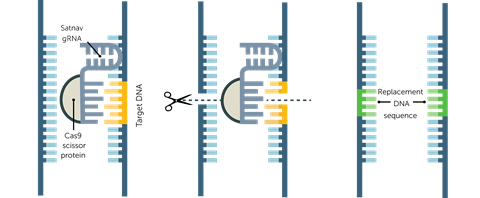
这凸显了寻找治愈HIV的第一大障碍:难以定位隐藏在患者细胞中的潜伏HIV前病毒。这种病毒潜伏在一种被称为CD4 T记忆细胞的长寿免疫细胞中,但其他可疑的庇护所包括被称为巨噬细胞的漫游免疫细胞和被称为小胶质细胞的大脑免疫细胞。艾滋病毒科学家目前正在努力掌握潜伏感染细胞的数量,并正在讨论可能的储存位置。“我们知道主要的延迟点,但可能还有其他我们还不知道的地方,”梁说。卡伦表示同意。“如果你能让Crispr进入正确的细胞,你就可以编辑并摧毁艾滋病毒,但我们现在没有现成的工具来做到这一点。”
提供必要数量的火力也是一个问题。Cullen估计,一个成年人可能需要一升浓缩的慢病毒载体,以确保有效地攻击几乎所有受感染的细胞。他补充说:“这可能会引起强烈的炎症免疫反应。”梁最近的研究显示了另一个问题——他成功地使用Crispr灭活了HIV-1,但在HIV-1中发现了Cas9蛋白结合位点的突变,这将使病毒逃脱Crispr靶向。3.最后,还有脱靶基因编辑效应的问题。如果你用基因编辑器攻击体内的每一个记忆t细胞,你就有可能无意中打开一个癌症基因或关闭一个肿瘤抑制因子。虽然对于患有恶性肿瘤的癌症患者来说,这可能是可以接受的风险,但对于大多数艾滋病毒患者来说,这是不可接受的。
“与服用相对安全、高效的抗逆转录病毒药物组合相比,需要有明显的优势,”他说华纳格林他是美国格莱斯顿研究所和加州大学旧金山分校的医生和病毒学家。尽管如此,人们还是乐观地认为,Crispr迟早会带来一种治愈方法。“我对我们正在研究的Crispr系统有信心。希望我们能找到一种方法,把它输送到艾滋病毒潜伏期细胞。”他正在与医疗保健公司开会,讨论如何将这项技术作为治疗艾滋病毒感染的工具。
基因编辑
另一种策略不寻求切割艾滋病毒,而是编辑患者自己的细胞,使它们不再容易受到病毒的影响。灵感来自一名已知已治愈的艾滋病毒患者。蒂莫西·雷·布朗,又名柏林病人,在2006年接受了骨髓移植,此前他自己的免疫细胞被化疗杀死,以治疗他的白血病。捐赠者有一种罕见的干细胞,携带突变(CCR5-delta-32),这意味着他们没有CCR5受体。基因编辑的想法是取出患者自己的t细胞并改造它们,使它们不具有这种艾滋病毒受体。
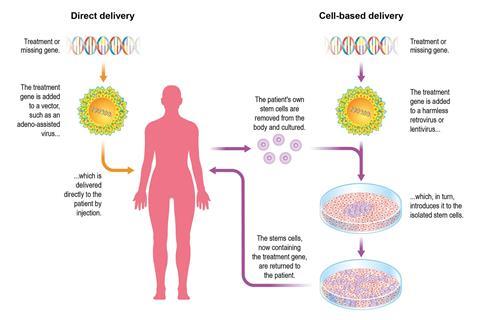
今年早些时候,美国国立卫生研究院向一个采用类似方法的团队提供了1100万美元(850万英镑)的资助。他们将从20名艾滋病毒感染者身上提取t细胞,对这些细胞进行基因编辑,然后重新注入。编辑将使用Sangamo Therapeutics公司的锌指核酸酶(ZFN)完成,这是一种先于Crispr出现的基于酶的DNA编辑器。这一编辑将使CCR5基因失效,从而消除艾滋病毒进入t细胞的大门,使其无法进入。
“这个系统是微创的。这就是它的美妙之处Rafick-Pierre时他是美国克利夫兰凯斯西储大学的艾滋病毒研究员。白细胞是在两到三个小时内从患者血液中提取的。使用ZFNs编辑CD4+ t细胞以去除CCR5,并在实验室中培养12天。然后,患者接受具有干细胞特性的T细胞,这些细胞可以抵抗艾滋病毒,并准备繁殖子细胞,以对抗病毒。
“我们已经证明,在两到三年的时间里,这类患者超过70%的t细胞被替换了。这是一个巨大的优势,”Sèkaly解释道。“被感染的t细胞不会永远存活,我们正在用不会被感染的t细胞取代它们。”他说,这样病人的免疫系统就会更有能力。它将开始执行杀死任何释放艾滋病毒的细胞的任务。在过去的五年里,77名患者接受了这种治疗,没有一例因不良事件而退出。我们预计(在即将到来的试验中)不会有任何变化,”Sèkaly说。“我认为这真的可以治愈。我们还没有证明这一点,但我们已经在这条路上了。他认为,两年后使用相同的细胞进行第二次注射,可以帮助提供政变一个ce病人的HIV感染
其中一个问题是钱。目前,Sèkaly估计每位患者的成本可能为2.5万美元,这个价格可能会大幅下降。其他人则不太确定细胞疗法是正确的发展方向。“如果我们谈论的是改造和再注入细胞,那么这种治疗方法在撒哈拉以南非洲是不可行的。我们不能满足于此,否则我们将抛弃那些艾滋病毒感染最严重的人,”格林警告说。尽管如此,仍有相当一部分艾滋病毒患者在服用逆转录病毒药物,并遭受严重的副作用,特别是神经系统疾病。由于抗逆转录病毒疗法不能治愈艾滋病毒,研究人员必须继续努力,继续寻找可能战胜艾滋病毒的策略。
在手推车上
最近,癌症患者的免疫细胞被提取出来,并与嵌合抗原受体(CARs)进行了改装,嵌合抗原受体是设计用于靶向癌细胞的对接点。这一策略现在正被用于艾滋病毒,科学家们设计t细胞携带一种混合受体,用于检测和杀死感染艾滋病毒的细胞。艾滋病毒识别CD4停靠位点包含在CAR分子中,用于发出艾滋病毒感染细胞存在的信号。
一个由斯科特厨房美国加州大学洛杉矶分校的一名研究人员报告了他们如何改造干细胞,使其不断产生携带CAR的t细胞。在人源化小鼠中,带有混合抗原的t细胞对HIV感染产生了抗性,并抑制了其复制。4他们随后发现,注入辫尾猕猴体内的干细胞被移植到它们的骨髓中,并开始产生针对艾滋病毒的子细胞。5“这些细胞会在动物的一生中植入,并产生t细胞和其他细胞来攻击艾滋病病毒。”没有不良事件或毒性,”基钦解释道。这一策略并没有消除感染,但对艾滋病毒有保护作用。
对于最初的几个病人来说,这可能是数百万或数十万美元
这种方法是有历史的。基因治疗公司Cell Genesys在20世纪90年代末进行了试验,改造了CD4和CD8 t细胞。这种疗法引导t细胞对抗艾滋病病毒,并经过了三次临床试验。基钦说,不幸的是,临床影响不大,部分原因是这些变化使CD8杀伤t细胞容易感染艾滋病毒。
基钦说:“我们通过对细胞进行基因改造来纠正这种方法,使它们免受艾滋病毒感染。”这是通过引入一种基因来制造干扰HIV CCR5受体表达的RNA,以及引入一种基因来制造一种可以结合并阻止病毒与患者细胞融合的小肽来实现的。基钦补充说:“除了嵌合抗原受体,这两种抗病毒基因还能保护细胞本身不受感染。”这个想法是从病人身上提取干细胞,改造它们对HIV病毒有抵抗力,然后改造它们针对HIV病毒,然后再注入病人体内,在那里它们永久地植入他们的骨髓。基钦解释说:“在它们的一生中,它们会不断地产生能够靶向艾滋病毒的细胞。”
他承认成本是一个问题,但他乐观地认为,这种方法可以在其他领域(如癌症)赶上CAR-T的浪潮。他说:“最初的几个病人可能要花费数百万或数十万美元。”“但这种方法目前正在其他领域研究,预计成本将大幅下降是现实的。”他希望一次性注射就能治愈艾滋病毒感染者,这比现在进行终身抗逆转录病毒治疗要便宜得多。
不要让沉睡的病毒躺下
攻击潜在病毒库的一种策略被称为“冲击和杀伤”,这是一种二合一的组合,旨在消灭那些携带潜伏病毒的细胞。今年早些时候,吉利德报告称,使用一种toll样受体兴奋剂,通过打开其固有的基因表达机制,将艾滋病毒从受感染细胞中唤醒,然后通过添加一种识别细胞表面表达的关键HIV蛋白(PGT121)的抗体来杀死受感染细胞。在猕猴中,11只动物中有5只在治疗后的168天内没有看到它们的猴免疫缺陷病毒载量反弹。目前,吉利德正在向人体试验的第一阶段迈进。
油藏问题将是一个棘手的问题
格林说,电击和杀死不太可能消除所有潜伏的病毒,因为有些病毒处于深度睡眠状态,对电击剂反应不佳。针对这类病毒的一种潜在方法是使用“阻断和锁定”策略或转录沉默策略将它们推入永久睡眠状态。这种联合策略很有吸引力,特别是因为目前令人震惊的药物只能刺激携带专利前病毒的细胞中仅有5%被现有的药物重新激活。6
他说,这个油藏问题将是一个棘手的问题。你可能只需要一个潜伏感染的细胞留在体内,就可以重新感染整个感染。”“我们不应该消灭所有病毒,而是应该设法减少潜伏感染细胞的数量,然后通过免疫系统有效地控制这些剩余细胞中的病毒,这样患者就可以停止服用抗病毒药物。”这种持续的病毒缓解在发达国家和发展中国家都非常有价值。”
另一个障碍是,许多复制体是有缺陷的,可能只有千分之一的复制体会产生新的感染。尽管如此,Sèkaly等研究人员认为,治愈艾滋病毒感染的方法是可能的,这将涉及修改患者的DNA,使他们的细胞更好地抵抗艾滋病毒本身,并在病毒出现时寻找并摧毁病毒。他说:“我们可以使用抗逆转录病毒疗法来控制病毒的数量,但同时也赋予免疫系统控制剩余病毒的能力。”
抗逆转录病毒药物对艾滋病毒患者取得了巨大的成功。下一个重大进展的舞台已经准备就绪,但谁将担任主角还不清楚。至少有许多令人兴奋的前景。
安东尼·金是一位生活在爱尔兰都柏林的科普作家
文章修改了8月22日,以纠正在基因编辑部分的第三段中给予患者的抗hiv细胞的性质
参考文献
1 Y Ophinni等,科学。代表。, 2018,8, 7784 (doi:10.1038 / s41598 - 018 - 26190 - 1)
2 C阴等,摩尔。治疗, 2017,25, 1168 (doi10.1016 / j.ymthe.2017.03.012)
3王震等,细胞的代表。, 2016,15, 481 (doi:10.1016 / j.celrep.2016.03.042)
4 A甄等,摩尔。治疗, 2016,23, 1358 (doi:10.1038 / mt.2015.102)
5阿贞等,PLoS病原体, 2017,13, e1006753 (DOI:10.1371 / journal.ppat.1006753)
6 E Battivelli等,eLIFE, 2018,7, e34655 (DOI:10.7554 / eLife.34655)









暂无评论