AlphaFold,这个人工智能程序之前已证明,它可以从一个氨基酸序列预测蛋白质结构,已经与其他两个人工智能程序提供一个端到端的AI的药物发现过程即使蛋白质结构尚不清楚。1这种结合机器学习过程能够预测一种新型药物类小分子对肝癌的新目标,体现人工智能如何快速而准确地设计定制的疗法。
“对许多目标中涉及的疾病还没有已知结构。使用结构设计过程提供了优势,其他方法无法进行比较,”robert继续解释说Kamya, AI平台主管Insilico医学,该公司开发的技术输入艾伦Aspuru-Guzik加拿大多伦多大学的诺贝尔奖得主迈克尔·莱维特在美国斯坦福大学的。
靶蛋白的结构通常是来自x射线晶体学等实验方法。然而,可以有困难在获得这些结构和全新的目标获得一个x射线结构可能会耗费大量的时间。
计算机程序提示AlphaFold,承诺解决这个古老的蛋白质折叠问题,声称已生成的所有蛋白质的结构在人类基因组中,“Kamya说。显示的好处使用AlphaFold生成目标蛋白质结构,研究团队Insilico医学配对AlphaFold与他们已经开发出两个人工智能程序;PandaOmics Chemistry42。
PandaOmics可以筛选,和解释,各种组学数据。组学数据通常是获得高通量生化分析和使用这些信息与文本挖掘的科学文献和格兰特描述寻找可能的治疗靶点。PandaOmics是目标发现引擎,提供了洞察disease-target关系,可能是以前被忽视,有充足的证据来支持连接,“Kamya解释道。
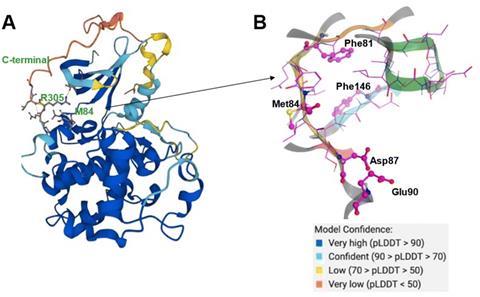
朝着一个小分子,对肝细胞癌常见的肝癌,团队在InSilico利用PandaOmics发现蛋白质的解释力量CDK20作为一个合理的治疗目标。CDK20是过表达在肿瘤细胞株和减少这种蛋白质在肺癌细胞与细胞增殖减少和增加对放射化学治疗的敏感性。虽然没有蛋白质结构的实验,AlphaFold CDK20建议一个可能的结构。
从目标到30天
接下来,团队搭配AlphaFold预测结构生成AI Chemistry42,暗示CDK20小分子抑制剂的结合位点。通过分析AlphaFold-predicted蛋白结构,Chemistry42建议浅绑定150袋3。进一步调查这个口袋里通过人工智能的生成日常合理的化学结构编织在一起,看到它半个,官能团提出一系列的配体。这些配体设计的3 d形状绑定在CDK20口袋,可用的体积和空间安排关键的原子和蛋白质残留。AI建议54潜在的抑制剂,其中团队合成7。这个过程只花了30天从目标选择第一个,和后续改进Chemistry42发现更有效的达到分子抗癌活动演示实验测试。
相比在药物发现所需的时间和投资活动,这种表情的方法显示了巨大的优势,在药物发现显示了一个范式转变完全由人工智能预测和新创一代的化学结构,”言论巴勃罗Carbonell)大学计算生物学家在西班牙瓦伦西亚。
Insilico医学研究团队,接下来的目标之一是将端到端人工智能药物发现纳入机器人实验室,如他们的新工厂在苏州,中国。Aspuru-Guzik解释说,运行的实验室可以把AI-led药物发现与自动反应和药物制剂2建议通过机器学习一个加速的过程。
我认为下一个自然进化的公共开放的药物发现,“Aspuru-Guzik补充道。应该有联邦政府资助机构和非盈利性质工作被忽视的疾病。随着工具变得更便宜、更民主,为什么不创造一个联邦机构?”
引用
1 F任等,化学。科学。,2023,DOI:10.1039 / d2sc05709c
2 P Bannigan等,Commun性质。,2023,DOI:10.1038 / s41467 - 022 - 35343 - w










1读者的评论