结合光催化与organocatalysis打开大门,手性季中心
近年来,光化学的出现或文艺复兴——依赖于个人经验——终于清晰。Photoredox化学,通常使用可见光结合调解吸光催化剂氧化还原过程,导致了众多的时尚出版物主导。最近说,令人印象深刻的贡献“古典”光化学反应——利用紫外线辐射调解[2 + 2]环加烯烃羰基或Paterno-Buchi反应——也重新关注一个字段,可以失去了光泽。
古典光化学使反应在热条件下将“禁止”。因此可以提供生物活性支架不容易准备使用传统化学,使当代应用基本的字段和一个迷人的历史研究。在早期的photoredox催化,在2009 - 2010年,反对的声音认为它作为一种时尚,但持续卓越,指数增长的应用程序显示除了。小说转换使用醇类等广泛使用的试剂和arylnitriles拖垮了窗帘的批评。这些非传统的反应底物可以用于生成综合驯良的环境条件下自由基中间体。
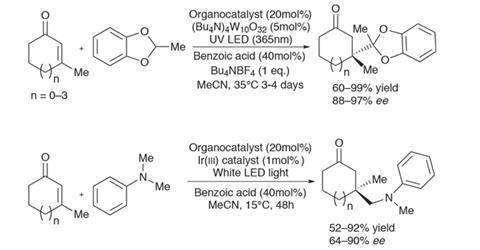
保罗Melchiorre和他的团队在加泰罗尼亚的化学研究所,西班牙,正在推动的边界photoredox催化领域的经典有机金属共轭加成反应。团队已经发现了一个不对称的方式形成季碳中心通过添加enones亲核的激进分子。使用巧妙构思redox-active organocatalyst,结合适当的光催化剂和紫外线或可见光near-ambient温度,benzodioxole-derived和alpha-amino自由基形成手性中心与令人印象深刻的收率和选择性(图1)。
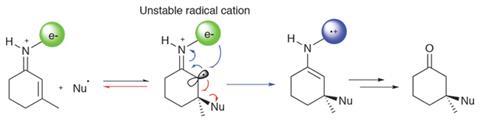
团队试图利用早期的过渡态碳碳键的形成亲核的激进分子和缺电子烯烃之间。“长”形成过渡结构的债券通常是对空间位阻。从概念上讲,反应的两个组成部分——形成亲核的激进分子使用光催化剂和激活与手性organocatalyst enones——建立。尽管两种活性成分的确是互补的,研究小组发现,初始添加产品将是一个不稳定的自由基阳离子容易改革起始物料,做一个成功的反应不太可能(图2)。
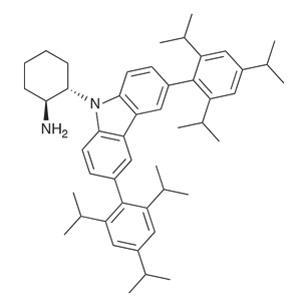
生物过程中获取灵感,研究者决定引入organocatalyst内的氧化还原活性成分。这将提供一个局部的分子内电子池快速降低瞬态自由基阳离子。这形成一个中立的烯胺物种tautomerisation后,确保不可逆键形成立体化学的侵蚀。咔唑杂环的单位提供了一个理想的电子池,由于其出色的电子供体功能和咔唑基阳离子的高稳定性——这就解释了为什么他们发现广泛使用发光二极管和光电池。笨重的取代基咔唑的修改其还原电位和提供更多enantiocontrol激进的(图3)。
成为第一个有效催化形成非对称战略第四纪中心通过激进的共轭加成,这项工作希望开门大量温和的转换,提供独特的第四纪碳基结构。然而,最突破性方面必须驯服的巧妙设计organocatalyst瞬态激进的中间。这个概念应该抓住,有望在多种方式开发提供精致的控制在反应一个松散的电子历来茂盛。
在德国卡尔·柯林斯领导一个药物化学实验室
引用
J J墨菲等,自然,2016,532年,218 (DOI:10.1038 / nature17438)











还没有评论