开发新药物的一个途径是看针对数百G-protein-coupled受体目前不利用临床。克莱尔桑塞姆调查
开发新药物的一个途径是看针对数百G-protein-coupled受体目前不利用临床。克莱尔桑塞姆调查
近你的每一次药,止痛药,哮喘吸入器或抗组胺剂,目标蛋白质产品的人类基因组。当然也有一些例外,抗生素和抗病毒药物目标感染寄生虫,和一些实验药物现在针对机械创造这些蛋白质。
或许更令人惊讶的是,十年人类基因组时代的部分基因组医学有趣的似乎没有显著改变。几十年来,五组的蛋白质已经被认定为组成药物靶点的最大比例:水解酶(包括蛋白酶),激酶,核激素受体、离子通道和细胞表面受体。最重要的无疑是细胞表面受体,它的目标是在当前临床使用药物的60%左右。
一群受体蛋白特别是已经上升到制药行业的卓越地位重要性——G-protein-coupled受体(GPCRs)。这些膜结合蛋白作为细胞的传播者。理查德·亨德森的医学研究理事会(MRC)实验室分子生物学在剑桥,英国一位经验丰富的研究员在膜蛋白的结构,描述了它们作为信号分子,控制整个生理的。
确切的统计数据是很难确定的,但在制药行业利润的一半来自GPCRs药物目标。和目标这些受体的药物清单包括一些最有名的和最广泛使用的药物,包括药物对偏头痛、β-受体阻滞剂对高血压、胃溃疡和泰胃美(西咪替丁)。其他条件可以控制药物针对这些受体包括精神疾病、帕金森病和某些形式的癌症。然而直到几年前所有生产工作在发展中药物目标蛋白质的家人没有一个药物开发中最重要的武器:详细的目标蛋白质的三维结构。
几乎800个基因在人类基因组中编码GPCRs,虽然略超过一半的这些活性无趣的嗅觉受体,使我们的气味。首席科学官专家菲奥娜马歇尔Heptares治疗药物研发公司,总部设在英国,韦林花园城解释说,这个行业已经做了多抓别人的表面。的五十6 370 non-olfactory GPCRs在人类基因组中已经药物在临床使用的目标。然而,几次,制药行业感兴趣的人数却未“麻醉”。候选药物的目标有一些进一步GPCRs在临床试验中,但是很多很大,亲脂性的分子通常具有较高的失败率,”她说。
科学家像马歇尔和亨德森-它们之间几十年致力于阐明这些蛋白质的结构和机制,相信知道GPCRs看起来像将帮助开发药物目标目前300余undrugged GPCRs。在这一过程中,他们希望能够履行先前未满足的医疗需求。
更清晰的图片
有两个主要原因GPCR结构已经被证明是很难确定的。首先,他们不是简单的具体化——膜结合,没有进一步措施,不能纯化和结晶。相反,膜蛋白纯化前需要水溶性清洁剂和说服-难以形成晶体。
虽然第一晶体结构的可溶性蛋白(肌红蛋白)于1958年出版,花了27年之前研究人员设法使具体化并解决膜蛋白的结构。蛋白质是细菌的光合作用反应中心,1988年,约翰·哈特穆•米歇尔Deisenhofer和罗伯特·胡贝尔被授予诺贝尔化学奖确定其结构。承认他们的工作了四分之一个世纪后,同样的奖被授予马克斯·佩鲁茨氏和约翰Kendrew调查haem-containing球蛋白的蛋白质的结构。
加利福尼亚大学欧文分校的史蒂夫·怀特,我们维护一个数据库,其中包含膜蛋白的结构,通常比较其增长与全面的蛋白质结构数据库、蛋白质数据库(PDB)。数据库的第一个版本是在1998年发表的,包含少于12个蛋白质,”他说。现在已经超过600结构,相当于1991年PDB,这些仅代表241截然不同的蛋白质。
第一个低分辨率和七个螺旋跨膜蛋白的结构是1975年获得的。这是原核的光敏质子泵,细菌视紫红质:GPCR的模拟家庭捕捉光能量,并使用它将质子跨细胞膜的细胞。
在接下来的15年里,许多分子生物学和x射线晶体学技术的发展奠定了基础,使得今天的详细图像成为可能。
第一个“真正的”GPCR屈服于结构性研究是功能相当于细菌视紫红质:光敏蛋白视紫红质。这些蛋白质共享一个配体、视网膜、视网膜的顺反异构化机制引起蛋白质构象变化,夫妻的g视紫红质和质子注入细菌视紫红质。
一群俄罗斯是第一个获得晶体的视紫红质。我记得一个年轻博士生向我展示一些粉红色的针头的时候参加2月(欧洲生物化学学会联合会)会议于1983年在莫斯科,”亨德森说。”这是视紫红质晶体。“在2000年,当Krzysztof Palczewski西雅图华盛顿大学的我们,Tetsuji冈田克也和日本理研研究所Masashi宫野从和他的同事们终于解决了牛视紫红质到2.8的结构
分辨率,闸门被打开。这不是马上,为进一步实验结构,但对于结构预测——“相同”或“比较”造型——使用更可靠的模型比不相关的细菌视紫红质。
解开结构
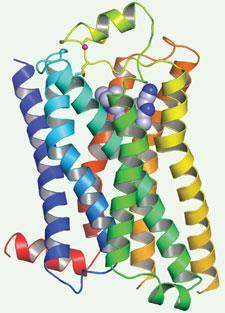
视紫红质结构表明,GPCRs由一束7成的

螺旋线,配体结合位点在包的中心和一个结合位点GTPase(蛋白)结合到细胞膜。当一个配体结合的受体蛋白质构象改变进入活动状态,导致交换鸟苷二磷酸(GDP)三磷酸鸟苷(三磷酸鸟苷)蛋白的释放GTP-bound GPCR的蛋白。这就引发了细胞内效应分子的化学反应。GPCRs已经绑定到各种天然配体和与许多不同的感受器,因此会产生一个巨大的范围的生理反应。
每个GPCR的事实可以在至少两个构象存在,“主动”和“活动”是另一个原因决定GPCRs的结构,即使在膜蛋白质,尤其困难。白解释说,“GPCRs必须能够轻松地从一个构象状态翻转到另一个——“关闭”到“on”——当一个配体结合。他们比大多数转移膜螺旋束,因此更不稳定,这使得他们几乎不可能与洗涤剂使具体化原生形式。”
引领
在过去的几年里,在这个领域的技术突破已经开创了主要由三组——克里斯·泰特MRC实验室分子生物学和两个位于加州,我们领导分别由射线史蒂文斯的斯克里普斯研究所和斯坦福大学的Brian Kobilka。
这些团队的工作导致的阶跃变化的前景GPCR结构的决心。以来的第一个DNA和蛋白质结构解决了在1950年代,结构生物学进展通过生物学和技术发展之间的婚姻,”史蒂文斯说。
开发的技术和方法组织是非常不同的。史蒂文斯和Kobilka的工作创建一个额外的亲水性域小蛋白融合到长循环的两个螺旋之间的包。虽然泰特使用定点诱变,依次改变每个残留,测量每一个突变体的热稳定性,然后结合“最佳”突变进行最优稳定受体锁在一个药物定义的构象。所有的团体都受益于先进的微光束从微小晶体x射线衍射,允许数据收集。许多膜蛋白晶体是薄,平面板很难,”怀特说。

Kobilka和史蒂文斯首先关注的结构

2肾上腺素能受体,最好的特征GPCR后视紫红质和知名的目标治疗哮喘的药物沙丁胺醇(舒喘灵)。Kobilka这种受体的基因,在1980年代末读博士后的罗伯特·莱夫科维茨的美国杜克大学实验室提供了生化的见解和专业知识在蛋白质工程中,史蒂文斯,世卫组织还致力于GPCR结构确定了20多年,提供必要的技术知识。
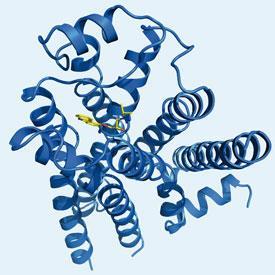
第一个结构的

2肾上腺素能受体GPCR发表在2007年之后,研究人员已经成功地“锁”的蛋白质活性构象。这涉及绑定一个小蛋白质-溶菌酶或一个免疫球蛋白域之间的两个螺旋,和部分反向激动剂配体结合位点。史蒂文斯的人类集团也发布结构

2肾上腺素能受体绑定到不同的配体,在2008年一个2腺苷受体。他们也决定结构其他医学上重要的人类包括趋化因子受体CXCR4受体,抗艾滋病药物提出目标,D3多巴胺受体的子类。
商业上可行
两个自旋公司已经出现了使用结构性知识他们获得了开发新药物目标GPCRs——圣地亚哥,美国Receptos是由史蒂文斯和Heptares从泰特集团剥离出来。
Receptos是主要解决的人类结构设置,设计配体,GPCR sub-family,结合磷脂sphingosine-1-phosphate (S1P)。之前的目标受体在这个家庭可以满足未满足的医疗需求,”史蒂文斯说。“我们的主要目标是S1P1受体亚型,多发性硬化的一个重要目标,但我们也感兴趣目标其他S1P受体亚型条件包括炎症性肠病”。
S1P Receptos第一的候选药物1变构受体激动剂,即将进入第一阶段试验对多发性硬化和调节GPCR的活动被绑定到一个站点附近活跃的站点。”知道不同受体亚型的结构允许我们设计特定的变构受体激动剂和拮抗剂,结合网站除了天然配体结合位点。这些网站在不同受体亚型多配体结合位点,并可以帮助减少副作用,”史蒂文斯补充道。
泰特,吉哈德Schertler和他们的同事的结构来解决

1肾上腺素能受体,高血压的一个重要目标药物,使用定点诱变稳定活性构象。“我们能够创建一个突变肾上腺素能受体,是野生型热稳定的400倍,通过结合六thermostabilising突变,“泰特解释说。
在2007年,当他们获得了衍射晶体,泰特的团队创建Heptares使用他们开发稳定技术获得GPCR目标和数据结构设计药物目标。马尔科姆•堰Heptares首席执行官解释他长期合作的项目。“我是结构生物学主管葛兰素史克在1990年代早期,当该公司第一次赞助剑桥集团GPCR结构。当时似乎一个棘手的问题,这使得我们最近的进展似乎更值得注意。”
公司已经能够提高? 2100万年风险投资即使在经济衰退的深渊。其知识产权是基于专利“稳定受体”(Star)技术和他们已经稳定下来了大约20个明星覆盖12个不同的受体在活跃的和不活跃的构象。事实上,白色,与他广博的知识的宇宙结构的膜蛋白,认为分数不同的GPCR结构目前正在从事的行业。
展望未来
它可能是有用的去问这些发展如何影响长期GPCR为基础的药物发现:该行业能做什么结构,它不能过吗?堰解释说,原子坐标并不是唯一有用的输出他们的新技术的进步。拥有可靠的技术获得3 d GPCRs结构是一个重大的发展,但这不是我们所能做的和我们稳定受体。我们可以看看配体结合直接使用表面等离子体共振和诱变;直接测量结合动力学;并使用所有这些信息目标药物更精确地变构结合位点。这将使我们能够设计更多的药物与更广泛的受体,并使他们更特定的受体亚型,所以可能会有更少的副作用。
堰和史蒂文斯认为,有足够的空间在他们的公司和更多。GPCR的家庭是非常大的和有足够的空间为我们两公司在这个结构领域。是的,我们是竞争对手,但是我们社团的,尊重和友好的竞争对手,”史蒂文斯说。
克莱尔桑塞姆是一个基于自由科学作家在剑桥,英国








还没有评论