科学家正在解码大脑的精致的分子机制,但仍有很长的路要走
慢慢地越来越多的痛苦的黑寡妇蜘蛛咬展示了可怕的大脑化学物质能导致的损失。蛛形纲动物毒液劫持的生化机制,指导活动神经元之间的突触连接大脑的神经细胞。像这么多发生在此系统中,我们可以部分解释蜘蛛的超级大国,但是仍然有很多东西要学习。
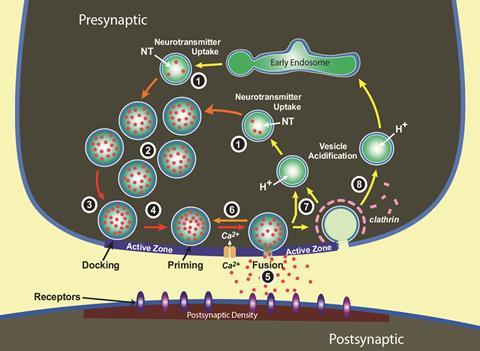
这是因为介意分子在我们突触做令人兴奋的事情。他们以不可思议的速度传递信息,使人类的动作和反应的奇迹。当电子神经信号达到它,让钙离子的突触打开一个通道,动员球体直径几十到几百纳米,称为囊泡。然后他们与周围的脂肪膜融合突触的“发送”方面,pre-synaptic终端。
过一段时间后,可以少于100微秒,小的囊泡释放神经递质他们封装,这一过程称为胞外分泌——在不到一毫秒的时间。神经递质达到后突触终端,对面发布网站,触发一个信号传递下一神经元在几毫秒。
没人知道这是怎么发生的如此之快,当托马斯•Sudhof现在在美国斯坦福大学,1986年开始他的实验室。在讲话中他解释接受2013年诺贝尔生理学或医学奖,他决心找出答案。”让我很是着迷的明显的不可知性(钙离子)——释放的速度,”他说。
尽管随后的令人印象深刻的发现,我们的无知还是超过了我们的知识,Sudhof告诉必威体育 红利账户。“我们真的不知道这已经提出许多分子的所有这些论文是涉及的许多突触通路,他说。
由分离分子的角色,然而Sudhof和其他科学家阐明我们的大脑的功能,比如内存,其障碍,如自闭症和老年痴呆症的疾病。今天,有一个癫痫药泡在市场目标蛋白质。和黑寡妇蜘蛛的毒液,以及同样毁灭性的毒素就像那些负责破伤风和肉毒中毒,也提供了一些重要的线索。
编排一只舞蹈
突触传递快速、精确的巧妙的组织的活跃区,与pre-synaptic膜囊泡融合的地方。活跃区机械码头和质数囊泡,使附近的钙通道,准备释放神经递质。在胞外分泌释放后,机器内吞作用开始,重建和注入囊泡准备下一个信号。蛋白质分子使这些过程大约四分之一的囊泡的球形外套,与胆固醇等脂肪分子形成的其余部分。
破伤风和肉毒毒素阻断神经递质释放通过阻止突触囊泡融合pre-synapse的脂肪细胞膜。从1990年代开始,Sudhof和同事表明他们肢解突触蛋白SNAP25, synaptobrevin-2 syntaxin-1。1找出他们的确切作用,Sudhof和他的团队纯化,分析和发现更多的突触蛋白质和基因编码。
这成为了世界范围内的搜寻,涉及科学家包括Eckart Gundelfinger莱布尼兹研究所神经生物学在马格德堡,德国。净化突触蛋白的老鼠的大脑,我们发现了两个非常大的pre-synaptic蛋白质”,Gundelfinger回忆说。然后创建gold-labelled抗体绑定到这些蛋白质在老鼠大脑突触部分,在电子显微镜下就出现黑色的斑点。这些蛋白质,称为短笛,巴松管,因为他们需要在和谐的工作像一个管弦乐队,只出现活跃区附近。2他们是非常大的支架,presynapse集成许多信号通路和流程,“Gundelfinger解释道。例如,某些类型的钙通道巴松管有助于精确位置。
这种蛋白质机械增加或减少一个突触的“力量”,这一过程称为可塑性与记忆和学习。通过钙通道,巴松管有助于调节神经递质释放,Gundelfinger解释道,突触强度。也许更有趣的是,巴松管和短笛也可以整合转录阻遏物在同一神经元调节基因的表达,”他补充道。这是非常激动人心的,巴松管有助于短期,特别是通过核信号,长期的可塑性。
吻和运行争议
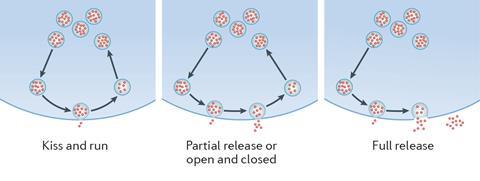
今天显微镜让科学家像针对Kavalali,从在美国德克萨斯大学西南医学中心,观察突触蛋白继续毫秒鳞片。通过修改它们与绿色荧光蛋白,他的团队监控神经递质释放胞外分泌和回收期间内吞作用。有竞争的假设内吞作用,Kavalali解释道。“一是每次,你复制从头囊泡。,他叫组装各种不同蛋白质泡需要足够快的一项艰巨的任务”。另一种选择是“吻和运行”,囊泡与细胞膜融合和部分开放,之前再次关闭。虽然这是一个有争议的想法,Kavalali的团队提供了证据的吻和像机制。3
更多的证据来自于实验,证明了安德鲁·尤因在哥德堡查尔默斯大学瑞典,错了。他着手证明囊泡总是发布他们的整个神经递质负载,而Gundelfinger Sudhof突触蛋白和其他人开始打猎。在历经了10年发展所需的技术,如细胞内囊泡的影响电化学血细胞计数(IVIEC)。IVIEC穿过细胞膜,50 - 100 nm直径碳纤维电极,而电压周期从低到高值。这种氧化,降低了囊泡破裂,释放出的化学物质,科学家测量微小电流变化,结果表明化学浓度。
使用IVIEC,尤因的小组发现囊泡在孤立的PC12细胞,大脑从大鼠肿瘤细胞模型,包含约114500神经递质分子,或19 zeptomoles。4但是当研究人员引发胞外分泌,电化学测量分子在细胞外发现只有大约73200。这样的实验表明,大部分空泡胞外分泌事件比预期通常更加彻底kiss-and-run -但不完全,尤因说。他解释说,机械Sudhof透露在他的诺贝尔奖工作频率影响毛孔开放,让囊泡释放神经递质。但如何接近是判定多少更重要的神经递质释放,他补充道。
的孔隙大小和关闭显然是调节这些事件,”尤因在午餐说监测分子神经科学会议在牛津大学,英国,2018年3月。“我相信监管涉及到膜囊泡释放改变。囊泡有不同的膜比周围的质膜细胞组成。一些膜交换。”
这种膜成分的变化是一个分子内存,可能会影响可塑性,尤因推测道。膜成分变化也将有助于解释药物和饮食可以影响突触的功能,他补充道。如果我吃三明治,它会发挥作用,”他解释说。例如,锌被认为是调节学习。尤因的团队已经发现囊泡在PC12细胞暴露于锌比那些没有包含更少的神经递质,但仍然释放胞外分泌的相同。5毒品如可卡因和哌醋甲酯也更改泡内容和发布以类似的方式。
艰难的目标
然而,Sudhof持怀疑态度。“没有真正的证据表明,吻和运行能这么快突触囊泡释放所有内容,”他说。但现在他也是研究领域有限的证据,如突触可塑性和组织成为期间受损的神经精神疾病。这就是关键的黑寡妇蜘蛛毒液,α-latrotoxin,提供了研究的一个重要途径。
α-Latrotoxin形成通道,让突触钙离子通过细胞膜没有神经信号。激活释放机械,导致洪水危险的神经递质。要做到这一点,它结合蛋白质在突触附近,位于突触前终端。早期蛋白质狩猎,Sudhof和他的团队找到了基因负责制造这些网站,neurexins I和II和命名他们的产品。
在随后的几年里,科学家们发现neurexins不仅仅是帮助黑寡妇毒素。他们结合neuroligins突触后终端,帮助使神经元精确,与20 nm左右的突触间隙。但是他们也与大脑紊乱。有许多基因的突变,容易使人患上精神分裂症,”他说。但最常见的一个基因协会和一个基因与多个基因关系,neurexin我。“Neurexin我也强烈与妥瑞氏综合征和自闭症有关,他补充道。6
但是Sudhof现任工作neurexins了解他们的基本功能是有限的,它告诉我们很少的关于可能发生在这些障碍,他承认。最终,我认为trans-synaptic细胞粘附机械、机械和突触后释放机械都必须联系在一起。但是我们真的不知道连接。”
很容易想象,很多事情可以在这个系统出错
今天,蛋白质组学是找到许多其他分子潜在的重要的脑部疾病。例如,Gundelfinger和他的同事使用高分辨率质谱来描述地面的老鼠的大脑细胞的蛋白质。结合自己的研究结果与其他蛋白质组学研究中,他们发表了SynProt突触蛋白目录在2012年,当时有超过2700个条目。7130多有缺陷时造成障碍。社区的许多突触蛋白的角度来研究函数,通常他们参与突触失败和大脑疾病,“Gundelfinger说。巴松管基因的突变,例如,最近与儿童癫痫和神经退行性疾病。
这是证据Kavalali称为突触的“精致的机器”。很容易想象,很多事情可能出错在此系统中,”他说。Kavalali想目标药物在突触囊泡机械来帮助保护它或弥补其不足,因为它几乎是“没有了”,他补充道。8原因之一是缺乏高通量筛选大量的分析潜在的药物分子集合对突触蛋白质。有一个瓶颈,Kavalali承认。
另一个问题是,一些组件非常普遍,像肉毒杆菌素的蛋白质目标,负责肉毒中毒的毒素。通过破坏突触蛋白,防止信号接收,它可以永久地放松肌肉,使其通过化妆和医学上都有用。但必须注射肉毒杆菌非常小心,因为如果它到达大脑,放松可以是致命的,停止呼吸。Kavalali表明其他药物可以在一个特定的网站,注射肉毒杆菌相似。或者,药物开发者可以目标突触蛋白只有在特定的细胞,他说。
但已经有一个新的药物靶点突触蛋白的机械。Levetiracetam,新一代的抗癫痫,特别是与突触囊泡蛋白结合称为SV2A,这被认为是调节神经递质释放。这药物都是通过内吞作用和囊泡与蛋白质结合,“Kavalali解释道。它有一个强有力的影响非常棘手的癫痫病。但它的功能,我们还不了解。”
灰质的阴影
突触蛋白的机械也参与这种疾病可能是有史以来最伟大的未满足的需求:阿尔茨海默氏症。还没有疾病修饰的药物可用,突出了塔拉Spires-Jones爱丁堡大学的英国。研究人员进行至少190种药品,主要关注减少蛋白β-淀粉样蛋白在大脑中建立,一个明显的阿尔茨海默氏症标志。,β-淀粉样蛋白和另一个叫做τ摧毁突触机械的蛋白质,并最终synapse-less神经元死亡。这种蛋白质逐渐传遍突触和神经细胞,也就是Spires-Jones研究。这是非常重要的在阿尔茨海默氏症,因为我们知道突触的损失是最强的病理相关的认知能力下降,”她说。我们认为这是推动疾病。”
Spires-Jones和她的同事刚刚发表的一项研究显示τ积累突触囊泡的人类阿尔茨海默氏症患者。9她的合作者,由Patrik Verstreken在比利时的鲁汶KU,果蝇和小鼠用于显示一个相对模糊的突触机械叫做synaptogyrin-3的蛋白质介导tau-induced突触功能障碍。
τ通常有助于稳定微管的运动产生的离子电神经信号,并可能防止低温冬眠的松鼠。但敲门τ基因在小鼠保护他们免受阿尔茨海默氏症突触的破坏。有几项研究表明,τ是重要的淀粉样beta-mediated突触的突触后致密物变性,“Spires-Jones说。“它的存在意味着有一些功能性突触的τ。
有患者团体真正等待的进步
阻止tau蛋白质扩散和持续伤害阿尔茨海默氏症病人的蛋白质机器可能会让他们形成新的突触,Spires-Jones希望。她建议使用类似的单克隆抗体药物与淀粉样β蛋白那些迄今为止没有目标τ,和给他们的疾病过程。但我们很长的路从能够有效地做到这一点,”Spires-Jones补充道。
考虑复杂性在我们头顶上使它明显为什么这是一个常见的说法从科学家在研究突触蛋白质。大脑包含大约一亿个神经元,每个连接到成千上万的人通过大约100万亿个突触。这并不奇怪,因此,成千上万的不同的分子控制它们。Sudhof调用找出重要的的一个重要的初始目标,但不是充分的。我们不能前进药物开发如果我们实际上并不理解的基本生物学,”他指出。
然而,最近会见癫痫患者在马耳他强调Gundelfinger寻求知识的重要性。突然间有意义的我们在做什么,”他强调。不仅仅是基础研究,这是适用的。有患者团体真正等待了解这些疾病的进展。”
安迪Extance在埃克塞特是一个基于科学作家,英国。
引用
1 H麦克马洪等,自然,1993,364年,346 (DOI:10.1038 / 364346 a0)
2 E D Gundelfinger等,前面。突触>。、2016、4 (DOI:10.3389 / fnsyn.2015.00019)
3 O T Afuwape和E T Kavalali,分子生物方法。,2016,1474年,187 (DOI:10.1007 / 978 - 1 - 4939 - 6352 - 2 _11)
4 X李等,Angew。化学。Int。。,2015,54,11978 (DOI:10.1002 / anie.201504839)
5 L任等,Angew。化学。Int。。,2017,56,4970 (DOI:10.1002 / anie.201700095)
6 T C Sudhof,细胞,2017,171年,745 (DOI:10.1016 / j.cell.2017.10.024)
7 R Pielot等,前面。突触>。、2012、4 (DOI:10.3389 / fnsyn.2012.00001)
李8 Y C和E T Kavalali杂志。牧师。,2017,69年,141 (DOI:10.1124 / pr.116.013342)
9 J麦克因尼斯等,神经元,2018,97年,823,(DOI:10.1016 / j.neuron.2018.01.022)










还没有评论