2015年的诺贝尔化学奖授予托马斯林达尔和阿齐兹Sancar莫卓奇DNA修复。马修·冈瑟重建他们的故事

物理结构,我们周围都散发出一种稳定——我们生活的家园或我们旅行的道路。他们用最好的意图经得起时间的考验,但都是容易受到不可避免的老化和衰退的威胁。救助他们,我们使用工具来修复它们,消除缺陷和保持完整。
2015年诺贝尔化学奖获得者意识到的分子结构,使我们我们是谁,DNA被锁定在同一个永恒的斗争。托马斯林达尔英国癌症研究中心前主任的克莱尔大厅实验室,莫卓奇在美国和杜克大学阿齐兹Sancar美国北卡罗莱纳大学的共同授予奖“DNA修复的机理的研究”。

生活生化研究的代码产生了深远的影响,我们认为不仅仅是人类基因组的弱点,但其战斗能力。早在1950年代,这不是一个问题对遗传学的先驱之一。詹姆斯•沃森克里克和莫里斯·威尔金斯,站在他们的新发现,双螺旋模型,保证这个结构稳定,几乎不变,在缺乏外部威胁等辐射。林达尔,这似乎令人费解。
沃森和克里克的日子里,他们发现双螺旋结构,这个美丽的分子,忠实地复制——好吧,你知道的,它不会,”说史蒂芬。西现在,林达尔的前同事和组长弗朗西斯·克里克研究所,英国。(林达尔)意识到DNA不像人们想象的稳定——这不是一块钢或像砖一样,这是一个物质非常脆弱。”
所有关于这个基地
林达尔的想法开始成型时的构象研究RNA在1960年代末。作为一个副业,他的研究,他决定隔离聚合物分子,加热到90ºC。RNA是不可逆转地破坏后30分钟。这种衰变,他假定,建议将核苷酸糖单位链接在一起的磷酸二酯键,RNA的骨干,被打破了。
但它不是最初惊讶许多化学家。“人类有很多核糖核酸酶的酶,这种酶分解RNA,所以大多数人认为我只是犯了一个微不足道的观察的实验工作,“林达尔解释道。但然后我做实验的次数,我自己的RNA,所以我确信它没有污染,然后我慢慢发现了RNA,慢慢分解,总是以同样的速度。据林达尔这观察很重要,因为它表明有一个常规的衰变过程发生,并不仅仅是污染的人工制品。
短的洛克菲勒大学博士后工作之后,我们,林达尔搬到瑞典卡罗林斯卡医学院和能够显示DNA遭受同样的命运。在斯德哥尔摩,我和我的实验室援助,barbroandreasson尼伯格,他神奇的实验室技术,我们可以显示DNA降解自发,“林达尔回忆说。
大多数人认为我犯了一个微不足道的观察草率的实验工作
DNA标签的革兰氏阳性细菌,枯草芽孢杆菌,14C放射性示踪剂,林达尔尼伯格迅速建立嘌呤碱基,腺嘌呤和鸟嘌呤,分子配对和订购的给我们的遗传性状,泄漏的DNA。一个分子的释放率表示,通常细胞发展至关重要,负责核酸的慢衰减——水。
在他细菌样本,林达尔指出,水解必须这个泄漏的罪魁祸首。在每个DNA核苷酸,其中有数十亿美元的一个链,有三个关键部分:含氮碱基连接由一个脱氧核糖和磷酸基糖苷键。林达尔发现,这种至关重要的糖苷键被hydrolytically裂解,使影响基地疏远双螺旋结构的安全,这一过程称为脱嘌呤。
除了去除水解基地,基地的自发突变,通过水解释放他们胞嘧啶或胸腺嘧啶,氨基的基地被林达尔也发现了。”的一个基本形式的细胞内DNA损伤是胸腺嘧啶的衰退,”西解释道。所以,胸腺嘧啶往往衰变形成尿嘧啶- DNA异常基地。
剪切、复制和粘贴
这样基地异常无法与他们之前基地合作伙伴形成氢键和诉诸形成新的债券与相邻的基地。这导致一个突变,可以随时通过细胞分裂和DNA复制。林达尔估计,到10000年这些突变,或病变,每天发生在每一个健康的人体细胞。置之不理,这样的攻击你的DNA变异,面目全非。奖得主很快发现为什么我们都仍然站着。1
分析大肠杆菌样品,他说,他第一次分析嘌呤衰变过程枯草芽孢杆菌类似于行动的模式在革兰氏阴性细菌的蛋白质酶,N糖苷酶,降低脱氨基胞嘧啶核苷酸,留下一个空的基地。
在未来二十年,后搬到英国癌症研究中心的克莱尔大厅实验室网站的新导演在1986年,林达尔和他的同事们一丝不苟地映射出这个修复机制,基本切除修复(BER),它在人类细胞的重组。2
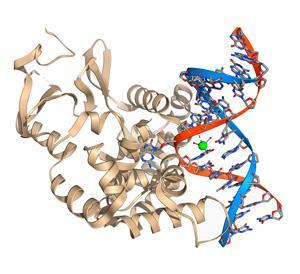
就像在大肠杆菌,uracil-DNA糖基化酶在人类细胞中定位的尿嘧啶基地弯曲DNA骨干为便于访问。enyzme夹层集团翻转的核苷酸基螺旋之前切断了尿嘧啶糖苷键删除。削减另一个酶,核酸内切酶,然后在剩余的核苷酸磷酸二酯键删除之前DNA聚合酶是粘贴到空网站产生一个新基地脚手架。
这是同样的原则作为一个牙医当他解决了一个洞,“林达尔解释道。”他稍微清理周围的洞得到一个干净的区域然后再填充。
你的DNA是保持在这种非常稳定的状态,因为这种往复——有DNA损伤和DNA损伤的识别和清除,”西说。这是托马斯真正意识到比别人早。
在这段时间里,林达尔和他的同事理查德•伍德,现在在德克萨斯大学MD安德森癌症中心在美国,也看看其他修复途径,激活,以应对外部紫外线辐射造成的损失。”托马斯知道我感兴趣的是紫外线照射效果和他特别感兴趣的核苷酸切除修复(NER),让系统工作研究尼珥的生物化学在人类细胞,”伍德解释说。
瑞士军刀
林达尔尼珥和木材的后续研究,类似的机制原则上误码率,极大地帮助了另一个2015年诺贝尔奖得主的努力,阿齐兹Sancar,和他的上司,院长拉普美国耶鲁大学,在1970年代末。
尼珥已经一个已知修复通路的时候Sancar加入鲁普的实验室1977年在他的博士学位研究。13年前,理查德。和简Setlow美国橡树岭国家实验室,建立了,紫外线可以激发和打破thymine-cytosine碱基对之间的氢键,引起胸腺嘧啶二聚体。这些二聚体引入基因突变和身体变形受影响的DNA链。更重要的是,然而,是Setlows能够表明,从DNA在这些二聚体大肠杆菌,这表明一个内部修复过程正在发生。
尼珥的作品就像瑞士军刀
在之后,保罗Howard-Flanders耶鲁能够隔离三个基因被认为负责,但没有人能够识别修复酶的蛋白质编码。如果他们能发现的蛋白质在起作用,遗传学家能够绘制出整个尼珥途径。?“我觉得,在那个时候,很少以来已经取得了进展阐明尼珥和它已经从早期的Howard-Flanders”基因的工作,…这是我的感觉,克隆的基因是一个办法,”鲁普说。
为了达到这个目标,鲁普招募了Sancar,一个有前途的研究员已经克隆一个基因负责UV-damaged DNA修复在他的博士学位。通过早期的讨论,两人意识到,如果你能克隆一个基因在细胞和警戒线从其余的主要染色体DNA,可能紫外线照射后生存和复制。这样我们可以标签…克隆基因和蛋白质的分离,“拉普解释道。
很简单,它工作。使用[35蛋氨酸,一种氨基酸标记,Sancar Rupp能够隔离三个修复酶参与尼珥,UvrA, UvrB UvrC蛋白质,使用这种大型细胞的方法。两人很快复制,在体外,主要步骤3进一步研究后,发现尼珥就像瑞士军刀,每个蛋白质都有不同的功能和作用一个接一个,特许权DNA损伤。
尼珥成功的UvrA-UvrB三聚物标识撞胸腺嘧啶二聚体引起的DNA。UvrA叶受损的网站,允许UvrC蛋白质结合UvrB DNA链。这两种酶催化磷酸二酯键的断裂,上游的胸腺嘧啶二聚体。然后从网站和删除12-base-long核苷酸聚合酶步骤再次填补的空白。
Sancar试图重现这个过程在哺乳动物细胞在接下来的几年里,与瑞克木和他的同事在1995年成功地这样做克莱尔大厅。
耶鲁大学但是鲁普,也许他们的主要贡献是在克隆工具箱创建它们。这是最方便的方式识别克隆蛋白质,当时,…还有其他不满意,快速的方法,”他说。当然有许多,如果不是数以百计,不同的基因产物,使用大型细胞方法识别DNA修复相关基因…没有。”
基因检查
虽然大型细胞方法识别特定的蛋白质,在1980年代开始质疑莫卓奇DNA有自己的机器识别基地和检查是否在正确的位置。
当DNA链在细胞分裂,分裂和复制数十亿基地必须正确对齐,以确保我们的基因信息不变异,依然完好无损。但对于每一个复制,数以百计的错误可能发生,基地不配对正确的合作伙伴。
一些不匹配是无害的程度,有助于解释整个人类多样化的特征。这是其中一个原因你你,我我:我们继承自父母非常微小的变化,其中大多数是无害的,”说鲍勃LahueModrich的一位前同事,现在基于染色体生物学中心的爱尔兰高威国立大学。他继续解释,然而,一些不匹配会破坏基因组DNA复制和增殖。
在1970年代,遗传学家发现酶再次拿起电话来修复这些有害基因不匹配后被甲基化路标引导破坏网站。马修Meselson在美国哈佛大学的遗传学家,和Modrich同意合成DNA链是不正确的,而不是完整的原始链,可能缺乏甲基磷酸沿着骨干。这将作为一个指示器的修复酶可以区分甲基化状态。
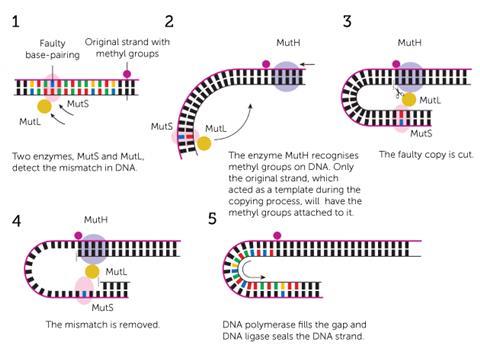
杜克大学在1989年,Modrich和Lahue能够识别蛋白质负责以下甲基路标和完全重建修复过程在试管中。4“基因检查,”Lahue解释道。所以,就像当我们输入一个文档…这是常见的最后回去解释清楚,确保你没有错过任何东西。”
这个检查由七个主要的酶。傻瓜蛋白缠在基本的拼写错误和MutH结合在甲基化位点的上游链。MutL酶桥连接两个和指导MutH削减新,不匹配的链。这允许所有的酶一起解压两个DNA链和删除包含不匹配的核苷酸的很大部分。使用原来的链作为造型,聚合酶形成一个纠正核苷酸序列的空间。
这是一个非常简单的机制,熊相似数量和尼珥,走很长一段路要复制后修复那些成千上万的拼写错误。“什么错配修复,这跟前,进去后,删除所有但约1000年(的错误),“Lahue说。这减少了错误频率约1000倍。
房子的卡片
但不是万无一失。这个修复系统的知识可以帮助突出缺点以及他们如何会导致遗传性疾病,根据西方。(Modrich)在人类细胞中发现这种错配修复系统,他还发现有患者发展肠道癌症,”他说。“这些肠道癌症患者在这种错配修复系统缺陷。
有一些例外,错配修复实际上是坏人
这是一个类似的故事为尼珥和病人患有着色性干皮病,一种障碍,皮肤对紫外线损伤非常敏感,患者可以合同多个皮肤癌。这些病人是缺乏一个酶催化这个删除sunlight-induced DNA损伤修复过程中,“西说。这是一个基本修复通路和癌症之间的直接关系。”
在一些罕见的情况下,非常机械用于修复DNA可以反对我们,研究人员如Lahue才刚开始发现。“有一些例外,错配修复实际上是坏人,“Lahue警告说。遗传学家认为,错配修复实际上可能有助于引起亨廷顿氏病,神经退行性疾病。特定的DNA修复酶,如Msh2可能搭上DNA链在错误的地方完全和变异的碱基对小姐。
这样的研究可能会给人的印象,人类基因组是非常脆弱的,支撑像纸牌做的房子。但是,当要求,机械林达尔Modrich和Sancar发现补丁的裂缝和停止泄漏数千次每天保护你——DNA构建一个稳定的房子。
引用
1 T林达尔Proc。国家的。学会科学。美国,1974,71年,3649 (DOI:10.1073 / pnas.71.9.3649)
2 Y日本久保田公司等,EMBO J,1996,15,6662年
Sancar和W 3 D拉普,细胞,1983,33,249 (DOI:10.1016 / 0092 - 8674 (83)90354 - 9)
4 R S Lahue K G盟,P Modrich,科学,1989,245年,160 (DOI:10.1126 / science.2665076)












还没有评论