公司说服监管机构,但医生会使用它们,并将供应商支付?
阿尔茨海默病抗体治疗的制造商Leqembi (lecanemab)说服监管机构在美国升级的地位完全批准进一步,基于试验数据接收后种抗体抗体被授予加速1月批准。
这意味着药物现在可能通过美国国家医疗保健方案,而其他保险公司将做出自己的判断是否和他们如何覆盖它。
与此同时,试验的结果礼来公司的类似的抗体,donanemab清晰的淀粉样蛋白也显示类似的能力,病人的大脑,并减缓认知能力的衰退在阿尔茨海默氏症的早期阶段。现在该公司将申请在美国监管机构的批准。
这些结果绝对是令人鼓舞的。他们确认(经过数十年的失败),药物干预可以有一个可衡量的影响大大衰弱的疾病。但值得保持的角度来看,这些疾病的药物提供了一个温和的放缓(迄今)不可避免的进步,通过几个月的18个月的审判。他们不是治疗,并不能扭转认知能力的任何损失。
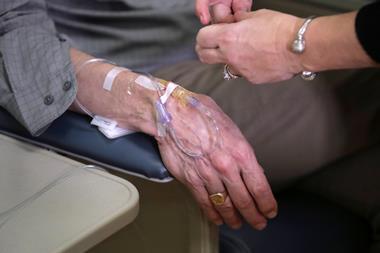
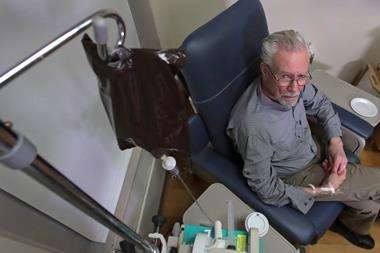
他们也有相对较高的成本,财务和医疗资源。它们包括每月的静脉输液,必须定期监控和病人的副作用,包括接受脑部扫描来检查肿胀或出血。
生原体和卫材似乎已经说服了美国食品和药物管理局(FDA),在没有更好的东西,这些抗体都值得一试。未来几个月,年将决定医生和哨的人一致认为,利益证明行政管理,金融和副作用的负担。
它将同样至关重要,看看世界其他地方监管机构的lecanemab和抗体。欧洲药品局(EMA)是其美国同行更谨慎考虑Biogen-Eisai的第一代阿尔茨海默氏病的抗体。虽然FDA允许Aduhelm (aducanumab)到美国市场2021年(诚然与各种限制在其加速审批路径),EMA拒绝了由于缺乏足够的好处,和生原体退出应用批准。最后,它有效未能说服医生年代和卫生保健提供者的价值。
lecanemab的临床试验数据和donanemab绝对比aducanumab更强大和更令人信服,但临床效益保持谦虚和副作用的威胁依然存在。一如既往,它归结为利益和风险之间的平衡。
















还没有评论