随着我们对阿尔茨海默病的认识发展,克莱尔桑塞姆需要看看新兴策略治疗这种神秘疾病
一个多世纪前,一位中年奥地利女子名叫奥古斯特·阻止被法兰克福一家医院的神经和心理症状,现在痛苦地熟悉数以百万计的老年人,他们的亲戚和朋友。

高级医生检查了她,阿尔茨海默,一个做了一个详细的案例研究,在她死后一年1906年,发表了一篇论文特有的大脑皮层的严重疾病。1论文中描述的特定神经功能——纤维特征厚度和奇特的攻不betway必威游戏下载大全破,“小粟粒状的疫源地”——显然是知名的神经原纤维缠结和淀粉样斑块特征的疾病,现在以他的名字命名。诚然,进步的老年人心理恶化的概念已经承认自古以来,但阿尔茨海默氏症的患者一般年龄范围以外的障碍是第一个明确识别综合症与特定精神和组织病理学特征。betway必威游戏下载大全
到了21世纪,阿尔茨海默病已成为公认的全球作为一个至关重要的卫生问题。全球国际阿尔茨海默病的集体身体阿尔茨海默氏症社会,在2010年的年度报告2现在,全球有3500万人患有痴呆,或认知功能的逐步丧失;阿尔茨海默病是最常见的这种类型的条件。照顾这些人的总成本估计约6400亿美元(?390 billion) - roughly equivalent to the gross domestic product (GDP) of Turkey or Indonesia.
目标在望?
许多分子机制参与进步导致阿尔茨海默病的神经功能变化已经被认可。被广泛接受的淀粉样蛋白假说关注短肽的聚集,β-淀粉样蛋白(β)在大脑中的神经元疾病发病机理占主导地位的重要事件。这导致神经元死亡,从而在大脑皮层的收缩和认知缺陷疾病的特点。
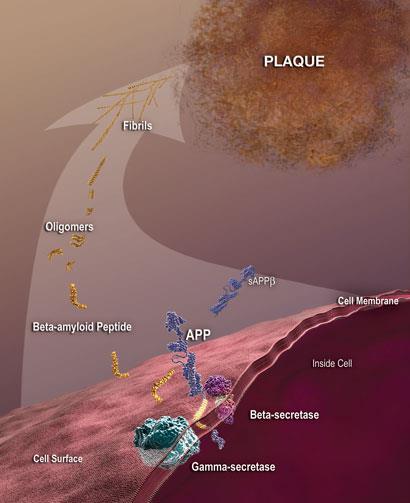
β-淀粉样蛋白的裂解膜结合淀粉样前体蛋白(APP)由两个蛋白酶被称为β-和alpha-secretase;它有多种形式,其中最不溶性和最有毒的长42个氨基酸。这是“有毒”应用乳沟通路;在“正常”途径,alpha-secretase劈开β-淀粉样蛋白区域内防止其形成。”有很多争论在过去20年里对β-淀粉样蛋白聚合引发阿尔茨海默病的程度,因此,药物目标这个动作应该有多好”,表示中心的丹尼斯·阿兹哈佛医学院神经疾病,波士顿,我们。但该领域的大多数人现在认为,淀粉样蛋白聚合是致病的关键过程,并讨论的重点是有毒物种的性质。有证据表明,可溶性proto-fibrils,小的寡聚物,甚至β-淀粉样蛋白二聚体是有害的,而这些环绕,化学平衡与不溶性淀粉样斑块。
症状缓解
尽管巨大的进步在理解的机制,导致阿尔茨海默病的发展,一些药物进行治疗的条件。更重要的是,所有四个anti-Alzheimer药物在临床使用的目标症状,而不是分子机制。三,安理申(多奈哌齐),Exelon(卡巴拉汀)和Reminyl(加兰他敏)是酶的抑制剂乙酰胆碱酯酶;他们增加神经递质乙酰胆碱的浓度,这是减少老年痴呆症患者的大脑中。第四,Ebixa(美金刚胺)块的另一种神经递质,谷氨酸,活跃在老年痴呆症患者造成进一步损失的神经元。
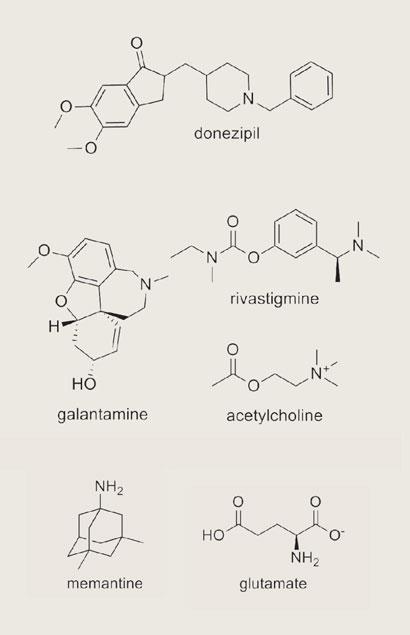
然而,这些药物给充其量只是暂时缓解了毁灭性的疾病的症状。有一个迫切需要治疗,可以永久停止,甚至扭转引发的神经退化
β-淀粉样蛋白聚合。研究在过去的20年里取得了很多分子目标的化学机制淀粉样蛋白通路,但尚未通过临床试验。阿尔茨海默病国际投资研究引用了相对缺乏条件的原因之一,随着全球增长了30倍需要给平价与癌症。这是一个有效的点,但阿兹喜欢引用的困难发展药物干扰这样一个复杂的机制。我们有一些试验结果令人失望,但这并不意味着淀粉样蛋白通路是一个无效的目标。它更多的是尚未充分测试。
当前候选药物在临床试验中目标通过许多机制阿尔茨海默氏症。一些最先进的免疫治疗药物。詹森免疫治疗是老年痴呆症与辉瑞合作的大型国际三期试验bapineuzumab,一个目标的人性化单克隆抗体
β-淀粉样蛋白和从系统中删除它,轻度至中度患者的疾病。这是目前最先进的试验检测淀粉样蛋白假说在世界任何地方的,阿兹说。
很多临床和商业成功的药物在今天使用目标蛋白酶。β-淀粉样蛋白的蛋白酶参与劈理的应用,β,γ分泌酶,因此逻辑药物开发的目标。然而,都是没有问题的。γ分泌酶是一个复杂的,multi-subunit蛋白质也参与处理切口蛋白质。切口对胚胎发育至关重要,但它的功能在成年后不太良好的文档记录。然而,Notch通路是特异表达在许多疾病,包括某些癌症。许多潜在的γ分泌酶抑制剂在临床试验中已经失败,主要是由于抑制切口处理,“阿兹说。不过,凯文·吉尔曼和他的同事们在瓦林福德百时美施贵宝,我们开发了一种有前途的化合物,bms - 708163,已经达到了二期临床试验。强烈抑制γ分泌酶几乎200倍,切口处理。β分泌酶是一个更复杂的蛋白质和一个潜在的清洁药物目标,但γ分泌酶抑制剂的开发人员不得不面对的需要产生一种化合物,通过疏水血脑屏障和亲水性蛋白酶活性部位结合。
让我们团结在一起
另一种机制目前引起阿尔茨海默氏症研究人员的注意和药物开发人员的聚合吗?淀粉样肽形成低聚物和斑块。乔安妮McLaurin神经退行性疾病研究中心的多伦多大学,加拿大,正在研究一组简单碳水化合物,肌醇或cyclohexanehexols,其中一些有显著anti-aggregation属性。1998年我们发现gamma-amyloid强烈结合一些脂质,这促进聚合。我们重复了实验用的肌醇头组脂质,并发现,令我们吃惊的是,附近的一个相反的效果:头部组织促进了无毒的形成,球形胶束”,她解释道。

的9个可能stereo-isomers肌醇,-scyllo肌醇-被发现明显比其他人更积极的体外。“我们喂scyllo肌醇在APP转基因老鼠携带突变基因和发展认知缺陷让人想起阿尔茨海默病,并发现它改善自己的行为,所以我们开始临床试验,McLaurin补充道。第一阶段试验显示没有明显的毒性,二期试验与爱尔兰公司合作?兰制药今年晚些时候预计将报告结果。另一个特别有趣的工作是所追求的迭戈μ?西班牙巴塞罗那大学的oz-Torrero:发展的多目标分子huprines donepezil-related结构都与主题,并抑制淀粉样蛋白聚合,β分泌酶和乙酰胆碱酯酶。3
这些只是一些有前途的例子不同的分子和目标考虑阿尔茨海默病的药物开发。他们的开发人员都同意,但是,大部分,如果不是全部,这个条件将工作更好的药物过程中早有这种疾病。任何药物作用于淀粉样蛋白通路,无论它的作用机制,将停止神经变性更容易比翻转。
早期诊断
一个条件称为轻度认知障碍(MCI)在老年人中是很常见的;的一个子集,这个条件恶化成成熟的阿尔茨海默氏症患者病例,但其他人可以保持稳定几年甚至几十年。最理想的情况是有针对性的阿尔茨海默氏症的治疗方法可用的子集MCI患者“进步”病,但这些患者在临床上是相同的那些病情稳定。考虑到大量的老年人MCI和任何可能的费用有针对性的阿尔茨海默氏症的治疗方法,许多研究工作正在致力于识别特定的早期生物标志物,最好是临床前,疾病。
加布里埃尔Vargas带领一群在巴塞尔的霍夫曼-罗氏公司,瑞士,开发生物标志物早期诊断阿尔茨海默病的同时使用成像和脑脊液(CSF)分析。成像生物标记放射性标记化合物结合淀粉样蛋白沉积,可以看到在正电子发射断层扫描(PET)扫描。老年痴呆症患者的CSF包含t蛋白的浓度高于平均水平,神经原纤维缠结的主要组成部分,,有趣的是,β-淀粉样蛋白的浓度低于平均水平。每个人都产生一个小的有毒,β-淀粉样蛋白肽”,巴尔加斯说。“在老年痴呆症患者,beta-42肽积累成骨料和斑块,所以在脑脊液浓度降低。”这两种类型的生物标志物提供积极的结果在患者在疾病的早期阶段,巴尔加斯相信在未来五年内PET扫描和淀粉样蛋白低,高温的CSF签名将使一个明确的诊断,排除或pre-Alzheimer MCI患者的病。CSF分析需要一个腰椎穿刺,入侵和昂贵的,”他补充道。在血液或血清生物标志物将代表一个伟大的进步,我们和其他组织正在积极致力于开发这些。”
行为生物标志物
一组基于行为和临床神经科学研究所,剑桥大学,英国正在采取一种完全不同的方法,阿尔茨海默氏症发展的生物标志物。Barbara Sahakian派生行为生物标志物,和她的同事们给明确区分一方面老年痴呆症患者和老年抑郁症患者(经常在认知测试中的表现不佳)和年龄组。MCI患者分层,与那些得分最多的疾病进展风险大多数老年痴呆症患者和那些稳定的疾病控制。这些测试包括记住屏幕上的图片和位置之间的关联。丽莎Saksida和他的同事们,也在剑桥,已经开发出一种等价的,和非常相似,触摸屏测试老年痴呆症有静电转基因老鼠,和工作在特定的测试承认缺陷的注意,这是第一个认知过程的影响。因为认知化验是如此相似,这项技术可以提供一个关键转化人类之间的桥梁患者和动物模型用于开发治疗的Saksida说。
与阿尔茨海默病和其它痴呆相关已经售价约占世界GDP的1%,和灾民的数量预计将增长两倍以上,到2050年,有一个巨大的需要更有效的治疗。目前的研究表明,有效的药物治疗的“机会之窗”将丢失一旦具有神经元损伤和认知的损失。结合药物阻止变性的过程和非侵入性的生物标志物识别个人在风险损失发生似乎是最有前途的方法。
克莱尔桑塞姆是一个基于自由科学作家在剑桥,英国
引用
老年痴呆症,Allg。z Psychiatr。Psych-Gerich。地中海,1907,64年,146年
2国际阿尔茨海默病的2010年世界报告
3 E Viayna等,ChemMedChem,2010,5,1855 (DOI:10.1002 / cmdc.201000322)









还没有评论