手性催化剂的新方法形成第一个,然后另一个对映体分子在中国开发了化学家。研究人员认为它可能允许访问两种对映体的新型药物分子通过相同的合成路线。
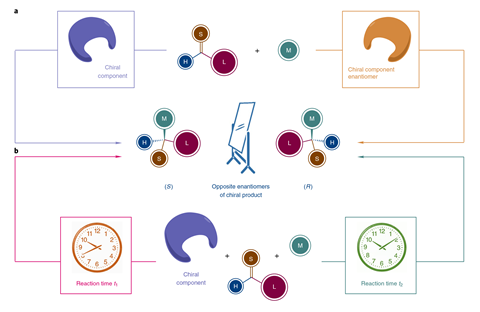
生物体homochiral,他们经常互动非常不同与一个比另一个对映体分子。在药物开发中,举例来说,这意味着这两个对映体因此必须调查。准备一个简单的战略相反的手性对映体是翻转反应物和催化剂,但源自生物分子有时是现成的只有一个对映体。因此,有机化学家发明了微妙的策略涉及优惠反应的对映体手性催化剂或试剂,产生的混合物enantio-enriched目标产物和未反应的试剂或副产品。
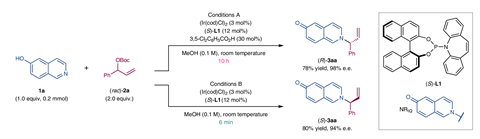
现在Shu-Li你和他的同事在上海中国科学院演示更复杂的策略。他们做了一个不对称的分子间烯丙基的氨基化6-hydroxyisoquinoline和外消旋之间叔(丁基碳酸——反应催化了年代)对映体的手性铱复杂,使用甲醇作为溶剂。令他们吃惊的是,他们发现,而六分钟后产生的反应(年代)目标胺对映体的94%过剩,当了10个小时,反应了超过98% (R)对映体。
进一步复杂机械的调查表明,手性铱催化作用的快速生产(年代从()胺年代)对映体叔丁基碳酸盐岩。然而,在长时间尺度,也催化作用一个醚的分解。6-hydroxyisoquinoline释放回的解决方案。
(年代)铱复杂反应的是一个更有效的催化剂的6-hydroxyisoquinoline (R叔丁基碳酸酯)对映体,所以(R)胺形式要缓慢得多。然而,它也不那么有效的催化剂分解,因此,(R在高纯长时间尺度)胺积累。研究人员发现几个相关的反应,一个类似的策略是有效的。到目前为止,这是第一个例子在不对称催化中,您可以使用时间作为enantio-switching的控制因素,“团队领导者Shu-Li你说:“我们可以告诉你更多的研究是多么广泛应用。
在概念上我认为这是非常有趣的,有机合成化学家说埃里克·费雷拉在美国乔治亚大学的。“更重要的是比直接适用原则方面的证据。他说他希望看到类似的反应方案演示系统中,只有一个催化剂的对映体是现成的。“如果你可以应用它,”他说,“我认为这可能是非常有用的。”
引用
氢氟键你等,Nat,化学。,2020,DOI:10.1038 / s41557 - 020 - 0489 - 1











1读者的评论