聪明的催化剂重新改经典亲核取代手性季碳中心
闻名的取代反应破坏立体化学已被改造成一个chirality-creating反应解决有机化学最艰难的挑战之一:第四纪碳中心。
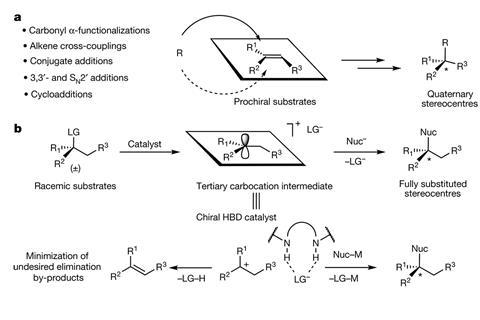
目前还没有完美的方法,使第四纪stereocentres。大多数方法依赖于使用pro-chiral基质——一种化合物像tri-substituted烯烃与定义良好的立体化学。但是让这些pro-chiral基质本身就是一个挑战。
埃里克·雅各布森来自美国哈佛大学,想出了一个不寻常的想法:他想控制在年代立体化学N1反应,亲核取代介绍有机化学课程的每一个学生都知道。它创建一个平面碳正离子中间体雅各布森认为可以充当pro-chiral基质。
然而,年代N1反应也破坏了立体化学。因为亲核试剂可以从任何一方接近碳正离子,传统的年代N1反应生成外消旋体,即使起始物料是单一对映体。我想谈谈年代N1机制来我的学生和我说“不是很有趣的如果你可以控制发货亲核试剂回碳正离子中间体?“‘雅各布森回忆说。而不是失去了立体化学,你可以创建它。
雅各布森和他的团队已经设计了一个催化N1反应,将外消旋混合物转化为手性季中心。开始的外消旋混合物炔丙基乙酸,乙酰氧基的手性催化剂删除组和交流一个烯丙基组,创建一个单一对映体。
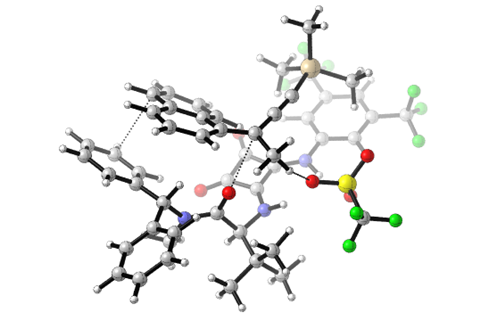
催化剂是一种手性形成氢键供体。它把衬底的离去基团,形成碳正离子中间体的离子对,只允许亲核试剂的方法从一边。工程有吸引力,非共价相互作用是控制立体化学的关键,”雅各布森说。
我认为这是一个非常漂亮的纸,“有机化学家说玛丽沃特森美国特拉华大学的。“值得注意的是,催化剂不仅使对映体过量,而且似乎保护的阳离子分解消除,”沃特森补充说。取消——碳正离子的失去一个质子和烯烃-是常见的形式N1副反应,往往难以避免。但雅各布森的催化剂离去基团结合紧密,不能参与消除反应。
虽然沃森指出,目前反应的范围有限,简单的苯不擅长稳定的碳正离子的对映体过量充电,给低于萘基板,它仍然是一个“领域巨大的一步”。(Jacobsen)打开了不对称催化的新边疆,“同意伊利诺伊大学,我们,催化研究克里斯蒂娜白。
我们的下一步是将范围扩展到不稳定化合物,但这将需要一个更活性催化剂,”雅各布森说。我们也喜欢做这个反应与其他的亲核试剂,氧和氮。
引用
E Wendlandt P Vangal和E N雅各布森,自然,2018,DOI:10.1038 / s41586 - 018 - 0042 - 1











还没有评论