强π-bonding拥有驯服的秘密双氧双游离基
自由基的潜在的破坏性反应蚀刻成公共意识,这很大程度上要归功于护肤品广告,然而我们不断,不假思索地,呼吸异常丰富的激进:氧气。
具有未成对电子,自由基反应迅速与周围分子。分子氧(O2)分子双游离基,有两个未配对电子,可以描述为一个未配对电子在每两个氧核。双氧参与许多链式反应的有机物,其中最著名的是火。
我们可以燃烧,不仅与激情
氧气是能源丰富而不是没有选择液体推进剂火箭,”在美国和比利时化学家在写他们的新纸。他们还指出,几乎所有的化合物在人体内“受制于与氧燃烧”。我们可以燃烧,不仅与激情。所以我们为什么不定期自燃?
答案很简单,分子氧活性比我们预期的要少得多双游离基。诺贝尔奖得主罗尔德·霍夫曼从康奈尔大学,所以我们问他的合著者,韦斯顿波登北德克萨斯大学的,为什么。霍夫曼,波登和他们的同事们发现他们的答案在分子氧的化学键。
结合相关由于分子的基本物理探索找到最稳定,能量最低状态成为可能。对于许多激进分子,从另一个分子偷一个氢原子低能态是一个简单的一步。
但这并不是真正的双氧双游离基安全——我们能够呼吸,因为它通常使氢原子在我们的组织中,以及在其他地方,孤独。然而,构成一个逻辑问题:你如何学习的事情不会发生?
在必要的地方,波登,霍夫曼和他们的同事因此转向理论计算,但小心翼翼地开始实验数据。他们利用反应热指示如何更低或更高的能源产品涉及分子氧的反应双自由基是比他们的起始原料。我们的论文的一个重要特性是我们混合好,校准理论与实验热化学,”霍夫曼说必威体育 红利账户化学世界。
稳定的激进
霍夫曼,曾合著的一出戏叫什么氧气指出,氢和分子氧的反应是高度和臭名昭著的放热——这是负责兴登堡飞艇的毁灭。然而,在这个过程中,第一步,分子氧抓住一个氢原子,需要一个大的能量输入,因为双氧比过氧化氢自由基形成更稳定。

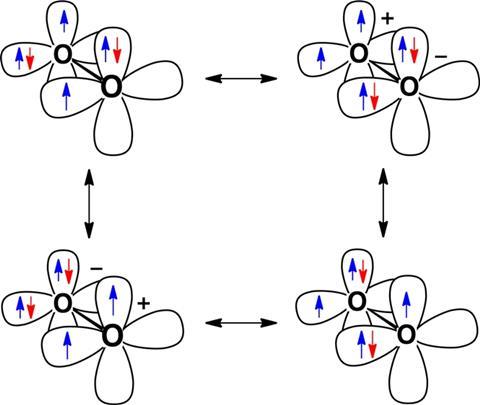
激进分子氧和过氧化氢是相似的,因为他们不只是分享电子σ-bond沿线两个氧核之间的直接。相反,也有π-bond涉及电子分布在σ-bond周围的空间。据价电子成键理论π-bond允许激进未配对电子离域和氧原子之间的移动,这被称为共振稳定。过氧化氢自由基稳定这样一个异于寻常未配对的电子。霍夫曼和波登解释双氧双游离基的低能量状态,因为它的两个未配对电子的稳定的两倍多。
霍夫曼补充说,这种影响的程度显示当羟基自由基和过氧化氢的反应给水和分子氧双游离基。在这个反应的数量和类型氢氧债券保持不变,波登解释道。的变化是,两个未配对电子,局部两个羟基自由基,成为一双异于寻常的两个电子,三电子,two-centre债券(di)氧气,”波登说。
因此这个反应的热量相当于分子氧双自由基共振稳定的能源,这在100千卡每摩尔,博登称“巨大”。化学家还展示了这种experimentally-derived匹配他们的理论计算值。
这些结果显示高明的分子氧的持久性是由于共振能量三电子债券的,说Sason Shaik以色列希伯来大学。理解这一发现的重要性,我们应该提醒自己,苯的共振能量,也就是36千卡每摩尔,关注化学家几十年来的思想。”
自发的驳斥
氧的共振稳定是备件立即点火的人。我们不燃烧,因为(di)的100千卡每摩尔氧气的共振能使加成反应(di)氧气发生非常缓慢,除了在高温下自由基形成,开始涉及(di)氧自由基链式反应,“波登说。双氧双自由基最终驱动燃烧反应,因为他们比π-bondsσ-bonds更弱,已经知道了几十年。几乎所有的最终放热性燃烧反应的弱点来源于σ-bond在分子氧,”霍夫曼说。
这是一个美丽的纸,解决了一个看似矛盾的地球上最重要的化学物质,”评论米歇尔·库特澳大利亚国立大学。这工作表明,共振的常常被忽视的作用使氧气如此特别。库特补充说,分子氧的双自由基性质经常被当作教科书价电子成键理论的失败。“但是这里作者表明,定量价电子成键分子轨道理论计算是一致的,可以占氧键和反应。
这些结果可能最终消除人类自发燃烧的神话?霍夫曼强调,化学家们试图做这160多年。他指出,格尔利茨伯爵夫人的自燃,邻居弗里德里希·8月凯库勒,第一次怀孕苯的结构。在试验中,开创性的贾斯特斯•冯•化学家李比希证实这样的事是不可能的。霍夫曼同样泼冷水团队的早些时候,炎症,我们可以燃烧的评论。“我们湿,除此之外,”他说。
引用
W T波登等,j。化学。Soc。,2017,DOI:10.1021 / jacs.7b04232












1读者的评论