一个国际科学家小组的研究提供了共价、给价和离子特征在一个键的证据。在某种程度上统一了长期以来关于碳碳类分子成键性质的争论,以前被描述为纯与价键,这项工作表明碳碳类分子的成键位于电子共享键和与价键之间。研究人员说,这为所研究的分子中与碳的配位键与过渡金属及其配体的更传统的配位化学之间提供了一个新的区别,后者形成纯粹的给键。
大多数人都熟悉碳原子利用它的四个价电子以无处不在的四价形式形成共价键。碳烯(CR2)含有一个价为2的碳,并在σ‐型孤对轨道中保留两个未共享价电子。碳原子是另一类含有二价碳(0)的分子。碳原子不共享电子,而是保留两个孤对,并通过给体-受体相互作用与两个配体成键。这与碳烯分子形成对比,碳烯分子具有电子共享键,并表现出不同的化学反应性。
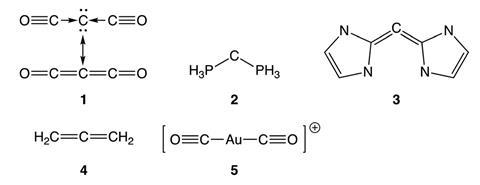
第一批引起化学家兴趣的碳化合物是碳二磷烷,因为它们表现出一种叫做摩擦发光的不寻常特性,当材料受到摩擦或撞击等机械刺激时,就会发光。它们也是异常强的路易斯碱。卡宾键不能解释这些性质,早期的研究将它们归因于给键。现在,来自Remco Havenith荷兰格罗宁根大学的研究人员及其同事认为,这并不是故事的全部。
Havenith和他的同事利用价键理论探测了几种碳化物中的化学键,并将其结果与具有电子共享键的等位烯和具有赋价键的金配合物进行了比较。他们研究的碳酮分子实际上位于共价键和给键之间,两者的组成部分都具有不同数量的碳酮特征。
“一些人所说的分子怪物或边缘情况,比如碳原子、等位基因或立方原子,帮助我们理解分子行为模型的极限是什么,”评论道米歇尔Francl他是美国布林莫尔学院的计算化学家。
“人们习惯用巧妙简单的刘易斯公式来描绘分子结构,但分子中实际的成键情况要复杂得多,”理论化学家评论道Gernot frenk来自德国马尔堡菲利普斯大学,他在碳化物方面做了一些开创性的工作。“化学物质仅由大约100个原子组成,而数百万种复杂的化合物是由原子间的化学键所形成的各种组合所产生的。Havenith和同事的工作证明了通过使用现代量子化学方法分析化学键所获得的洞察力。”
化学键有多种性质,而不是一种性质
米歇尔·弗兰克,布林莫尔学院
Havenith和他的同事说价键理论比分子轨道理论能提供更接近传统刘易斯结构的图像。通过价键计算,研究人员评估了每一种可能的价键结构对等位基因分子、三个碳原子和一个含有赋价键的金配合物的重要性。科学家们还进行了能量分解分析,研究每个分子的轨道相互作用能,发现碳原子在两个极端情况下具有轨道相互作用能。他们得出结论,与之前认为的不同,这些分子的成键并不是纯粹的与价的。
“这项研究确实提醒我们,当描述分子中的成键时,有多种方法来构建和解释成键。这种化学键不是一种性质,而是多种性质,我不向鲍林道歉,我认为他会同意这一点。”
Francl还指出,键性质的问题可能还没有答案:“我不确定这将结束关于碳键的争论,因为键并不是真正可观察到的,而是化学家在分子波函数中组织信息的方式。”








暂无评论