超级酷的显微镜赢得了2017年诺贝尔化学奖
“这是一个非常令人困惑的经验,”约阿希姆·弗兰克哥伦比亚大学的一次新闻发布会上说在美国,回忆那一刻他发现他被授予2017年诺贝尔化学奖。“我确信我要叫醒了我的新狗,但这个电话来了。
大约在同一时间弗兰克被吵醒,理查德·亨德森从医学研究委员会分子生物学实验室(LMB)在剑桥,英国,是听一个电子显微镜会议上演讲。他的电话响了。”我想“我在一次会议上被人包围,我现在不能说话,所以我拒绝了,”他说。但当他注意到电话是来自瑞典,他离开返回调用。Meindert[拉默斯先生,另一位LMB实验室研究员)以为我是被出去有点粗鲁,”亨德森笑着说。

与雅克Dubochet瑞士洛桑大学的弗兰克和亨德森,他们工作的发展中低温电子显微镜(低温电子显微镜)的高分辨率结构测定的生物分子在溶液中。
低温电子显微镜让科学家看生命的机械——DNA,核糖体、蛋白质和病毒——最逼真的状态。很酷的显微镜可以破译几乎任何生物分子的结构。经过多年的站在阴影的方法,如x射线晶体学,低温电子显微镜是目前增长最快的地区结构生物学。
但这是一个漫长的道路。获奖者的信念在低温电子显微镜的潜力,他们决心克服挑战,几十年来,最终提供一个方法奠定了基础,现在比以往任何时候都更容易捕获原子详细地生物结构。“[这是]一个当之无愧的奖,很长一段时间,”说斯蒂MacLellan-Gibson前在Dubochet集团博士后,现在全国生物学研究所的生物成像技术主管标准和控制Mimms南部,英国。
从x到e
自1950年代以来,当科学家开始看生活的分子结构,x射线结晶学的方法的选择。今天,22个诺贝尔奖授予结构阐明了x射线,包括DNA、肌红蛋白、离子通道和受体。
然而,正如其名,它依赖于一个水晶:常规晶体的原子排列。生物分子不是刚性的天性,这常常使他们棘手或无法使具体化。在晶体形成干燥,蛋白质可以被迫形状他们不会采用自然。低温电子显微镜另一方面,可以没有一个3 d晶体和保留工作生活的一个最重要的组件:水。

在1970年代早期,亨德森是努力使晶体细菌视紫红质,质子泵蛋白,一些细菌的细胞膜。隔离膜,蛋白质只是失去了它的结构,没有水晶意味着没有x射线晶体学。
然后在1973年,他回忆说“我听到了安文,奈杰尔谈论他的努力来改善电子显微镜”。与电子的波长正好询问原子的细节,和能够成像薄2 d, x射线会直接穿过样品,他们听起来就像他的蛋白质的完美方法。
在1930年代发明的,网一个诺贝尔奖恩斯特Ruska1987年新兴市场被广泛用于研究颜料,油漆,金属和其他非生物物质。但电子显微镜不是很适合生物分子:它需要一个高真空工作(这样电子束不被气体分子散射),干燥样品,和电子束的能量破坏共价键。基本上你会烧掉整个分子的解释道Sjors谢尔在LMB,亨德森的同事。
降低电子剂量可以减少这种损失,但这意味着弱对比。当时的一个解决方案是使用消极的污点——将重金属盐应用于样品。的染色形式的外面一层蛋白质“MacLellan-Gibson解释道。你真的高对比度的外面,但它掩盖了内部结构,因为电子与原子相互作用(在蛋白质)而不是原子在示例中,”她继续说。
安文亨德森和不满意这种方法;他们想要地图细菌视紫红质的内部结构。他们准备了一个脂双分子层膜含有细菌视紫红质分子和取代了水与葡萄糖溶液保持干燥。电子束疲软有助于减少结构性破坏。
研究小组还利用细菌视紫红质不寻常的特点:它实际上是一个二维晶体,膜内自然安排在一个高度常规方式。这意味着任何损害个体蛋白质平均在整个样本时可以忽略不计。
1975年,细菌视紫红质以其七个螺旋蛋白质链成为第一个使用电子显微镜生物分子结构来解决。1然而,决议7,仍有一段路要走到3 x射线结晶学的决议。这将是另一个15年之前亨德森细菌视紫红质结构的原子获得细节。2
一个不同的角度
尽管亨德森的突破已经利用蛋白质的周期性结构,其他样品含有随机分散的生物分子——都在不同的方向。
在早期的EM,马克斯·普朗克研究所的科学家们像沃尔特·霍普晶体在慕尼黑,德国,使用断层试图解决这个问题。这意味着重建3 d结构通过快照的样本来自不同的方向。弗兰克·霍普的博士生,他批评了他的导师的方法:“他从一个角度接近这个想法我认为不是有效的或仅仅是错误的,”弗兰克说。
断层的多个图像要求意味着样品高电子剂量多次的狂轰滥炸,弗兰克解释道。“最后,你有暴露的一个分子,结果是没有意义的。如果你从这样形成一个三维图像,你可能忘记。
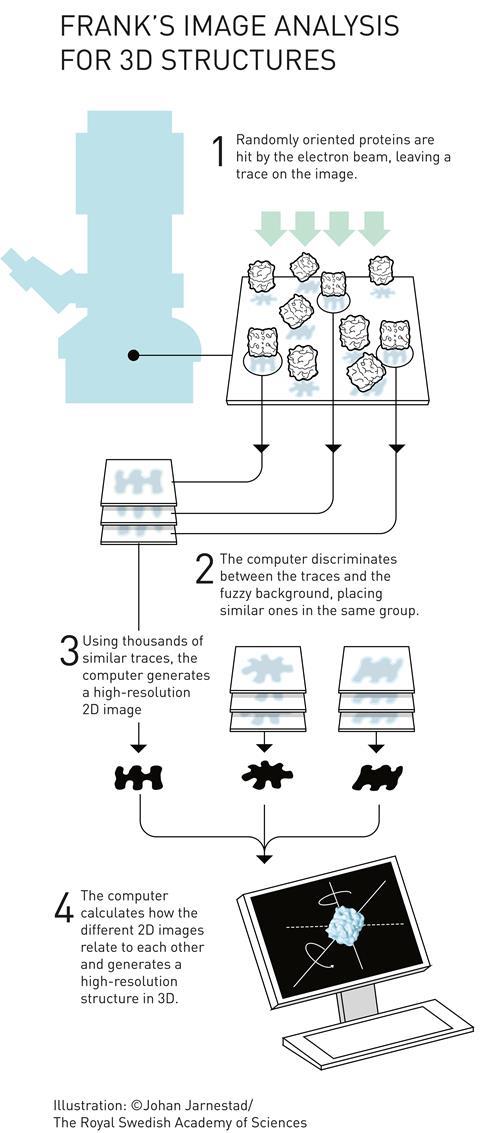
弗兰克意识到每样例与数以百万计的分子,一个快照已经包含许多不同的方向。所以你不需要倾斜分子,”他继续说。的想法,它倾斜。“每一个图像非常吵的,解释了谢尔。但如果你有足够的图片,你可以调整和平均。平均的信号仍但噪声被平均掉。”
在1980年代早期,弗兰克和马林范跟在弗兰克的实验室,然后访问学生,现在在巴西国家纳米技术实验室研究员,发表一个统计计算方法,组织和平均分子在不同方向和状态。3然而,一个问题仍然存在:如何2 d与3 d图像结构?
重建现实
您获得的图像实际上是一个二维投影,”解释了亨德森的LMB的同事Lori Passmore。这意味着所有的三维信息是倒塌的分成两个维度;甚至内部结构,”她继续说。
弗兰克重建3 d图像使用随机锥形倾斜的方法。4他把两个图片,一个样品在垂直于电子束和一个示例是倾斜的。这让他确定每个粒子的角度对电子束。数学技巧在正向和反向傅里叶变换的形式揭示了原始三维对象(见下文)。
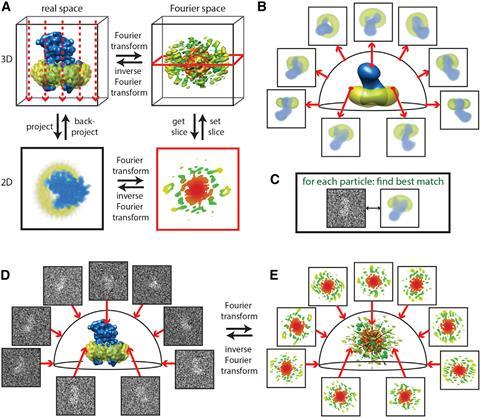
二维投影的傅里叶变换是一个中央截面三维傅里叶变换的原始对象,”谢尔阐述。”有多个二维投影图像从不同的方向,如果你知道的相对方向,你可以把所有这些2 d切片,通过逆傅里叶分析重建。”
弗兰克。建立了一个计算机程序叫做蜘蛛(系统进行处理的图像数据在电子显微镜及相关领域)倾角分组和三维重建。5他证明了它的力量在1987年用它来重建一个细菌核糖体的一部分,6它与显微镜工作者多年来一直是最喜欢的。最近才被其他程序,如谢尔Relion(主旨是优化可能性),这需要更少的编程经验。
液体冰
同时弗兰克正在蜘蛛,Dubochet刚刚开始自己的研究小组在海德堡的欧洲分子生物学实验室,德国。Dubochet不开心使用干的标本,或水换成了葡萄糖或塑料树脂。他想看到生物分子在自然,水化状态。如果你没有水,它的分子,像鱼一样,已经死了,“Dubochet说在接受诺贝尔媒体。
“他有一个爱的水从一开始,“回忆道Alasdair McDowall新兴市场中心主任,加州理工学院的我们,曾与Dubochet。“水是美丽的在他的眼睛。要因为这就是生活的全部。”
之前多次使用冷却停止样品在显微镜的真空脱水,以及保护他们免受辐射伤害。问题是,冷水使冰。除了破坏脆弱的生物结构,晶体冰强烈期刊电子束。从冷冻样本无用的EM拍摄的图像。
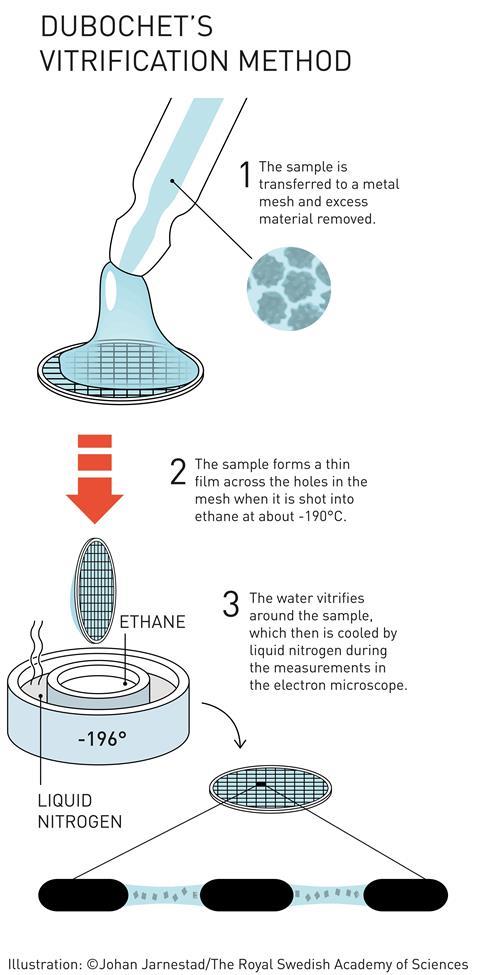
但如果冰不是水晶,那么它几乎是完全透明的电子。因此Dubochet的团队工作嵌入在玻璃冰——一个非晶样品,冷冻水的玻璃样的形式。这一点,玻璃冰是罕见的,只有观察过冷金属薄层。水滴能被冻在冰玻璃被认为是大胆的,至少可以说。
这并没有阻止Dubochet。使用自制的暴跌冰箱(实质上是一个铁架一些松紧带),他的团队开始寻找一种液体,可以成为玻璃冷水如此之快。我们将样品分成不同的制冷剂,McDowall解释道。我们经历了整个化学课本的有机物液体制冷剂,保持在最低的温度,”他回忆说。
”,然后,有一天,一切都改变了我称之为一个“啊哈”的时刻,一个独一无二的时刻,一个明白,一个刚刚发现了一个真正的“Dubochet告诉瑞士日报Le临时工。他的团队发现,乙烷,通过液态氮冷却到-190°C,是完美的。
他的团队最终出版第一个跳水冻结的设置工作,组成的nebuliser和一个冷水澡。样品持有人通过喷雾水滴直接拍摄到致冷剂,从它被提取并放置在一个同样寒冷的显微镜。7
尽管Dubochet指出我们仍然不明白水的本质玻化通过我们的方法,他的方法改变了EM低温电子显微镜。玻化水在方法论成为最后一块拼图,给研究人员首次获得清晰的图像无污点的生物分子。
原子从一团
到1990年代初,低温电子显微镜已经获得了一个小科学,但“还是困难,人们制造更多的进步在理解生物学利用晶体学,或通过结合两件事,”帕斯莫尔解释道。原子分辨率似乎是一个不可逾越的障碍。“我们被困在五至七埃,”弗兰克说。
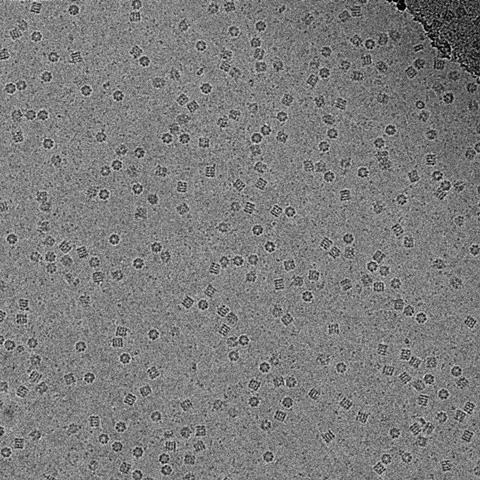
它被称为“blobology时代”,亨德森回忆说。“你做了一个结构和blob——你看不见原子是什么,没有化学。但他决心不放弃他的梦想,即使没有共享他的愿景。比方说,很多人认为他是一个乐观主义者,”谢尔笑着说。
解决气泡依赖另一个因素。,直到10年前,电子显微镜专家仍然使用胶片捕捉图像,尽管开发和扫描每个照片,没有可用的数字传感器直接捕获电子,而电子信号转换成光信号,增加噪音。然而,胶卷只捕获电子的四分之一。'因为你必须小心你使用多少个电子,产生了非常嘈杂的图像,”谢尔说。
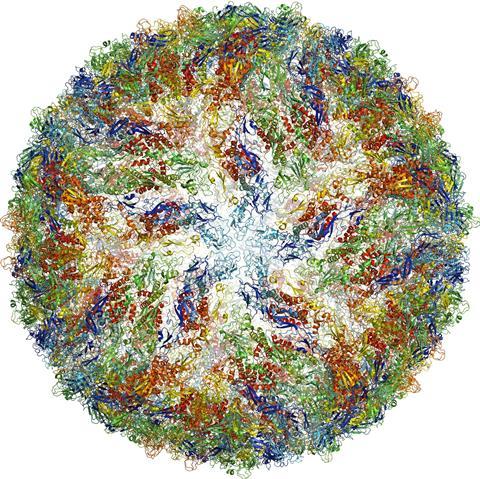
所以当直接电子探测器于2012年来到市场,低温电子显微镜准备好了。结构解决以下3 -以前x射线结晶学的领域不寻常了,说布丽姬特卡拉格是纽约结构生物学中心在美国。2015年,她的团队解决2.8 protein-degrading的结构复杂,8一年后,另一组解决蛋白质结构1.8。9
其中一个最小的结构成像是人类γ-secretase膜酶产生的短丝氨基酸聚合老年痴呆症患者的大脑中。10和在2016年Zika病毒流行,研究人员设法图像分辨率3.8病毒在几个月。11
低温的胜利
亨德森40多年后第一次与他们合作,“你现在可以把什么都或多或少地在显微镜:单粒子,病毒、二维晶体,3 d晶体,少量的细胞,细胞器,”他说。低温电子显微镜也发展到包括一个第四维度:时间。即时冻结保存分子在不同的动态状态,这使科学家独特的机会去观察细胞的分子机制。有电影的人类核糖体基因代码转化成蛋白质12ATP合酶,涡轮分子质子流转化为细胞的能量货币三磷酸腺苷。13
的低温电子显微镜派生结构存入蛋白质数据银行每年增加:2010年,仅仅53结构沉积;2016年超过400。“低温电子显微镜已经在过去的五年里,爆炸的Passmore说。这是罕见的,你看到一个字段移动如此之快,在你眼前改变。
和EM科学家们设置的门槛越来越高。原位观察结构是剩下的圣杯之一哦,”卡拉格说。前进的道路可以聚焦离子束铣,它使用扫描电子显微镜来切掉的部分冻结样品,直到只剩下一个小楔。“这将是一个很大的开放对于理解蛋白质要去哪里,移动和病毒细胞内的一切活动经常在部分我们看不到,“McDowall说。卡拉格补充道:“这项工作仍然非常具有挑战性但非常兴奋,我们都期待着在这一领域新技术的发展。
爱因斯坦从噪声
尽管先进的计算工具可以从低分辨率EM提取漂亮的3 d结构图片,他们有自己的缺陷。2013年,哈佛大学的研究人员声称已经阐明关键艾滋病毒的结构蛋白一个——一个声称是亨德森表示了强烈的不满,b范跟c和斯苏d癌症研究中心的贝塞斯达,我们。
三位科学家认为哈佛团队下降的爱因斯坦从噪声的陷阱:在随机找到图像背景噪音。你可以找到任何你想要的随机白噪声,“范跟解释道。自动化粒子搜索——特别是当完成了电脑被给予一个参考结构,使得它可以找到任何东西,即使样本不包含任何粒子。
哈佛团队反驳批评,详细说明他们的图像提取方法是专门设计来避免这个问题。解决6,他们认为,不可能是获得使用前一个结构与11决议参考。争端仍未得到解决。
今天的直接电子探测器非常敏感,科学家可以看到结构用肉眼和变得不那么依赖电脑区分分子和噪音。,“我们现在做的事情完全reference-free范跟说,尽管他警告说,计算机程序和用户仍倾向于偏见,可以使一个爱因斯坦的噪音。e
引用
1 R亨德森和P N T安文,自然,1975,257年,28 (DOI:10.1038 / 257028 a0)
2 R亨德森等,j·摩尔,杂志。,1990,213年,899 (DOI:10.1016 / s0022 - 2836 (05) 80271 - 2)
3米范跟J和弗兰克,Ultramicroscopy,1981,6,187 (DOI:10.1016 / 0304 - 3991 (81)90059 - 0)
4 M Radermacher等,j . Microsc。,1987,146年,113 (DOI:10.1111 / j.1365-2818.1987.tb01333.x)
5 J•弗兰克Shimkin B和H探寻水源,Ultramicroscopy,1981,6,343 (DOI:10.1016 / s0304 - 3991 (81) 80236 - 7)
6米Radermacher等,j . Microsc。,1987,146年,113 (DOI:10.1111 / j.1365-2818.1987.tb01333.x)
7 J Dubochet和W麦克道尔j . Microsc。,1981,124年3 (DOI:10.1111 / j.1365-2818.1981.tb02483.x)
8 mg坎贝尔等,eLife,2015,4e06380 (DOI:10.7554 / eLife.06380)
9默克等,细胞,2016,165年,1698 (DOI:10.1016 / j.cell.2016.05.040)
10得到呗等,自然,2015,525年,212 (DOI:10.1038 / nature14892)
11 D Sirohi等,科学,2016,352年,467 (DOI:10.1126 / science.aaf5316)
12 E代表等,细胞,2015,161年,845 (DOI:10.1016 / j.cell.2015.03.052)
赵13 J S Benlekbir和J L·鲁宾斯坦自然,2015,521年,241 (DOI:10.1038 / nature14365)
Y毛等,Proc。国家的。学会科学。美国,2013,110年,12438 (DOI:10.1073 / pnas.1307382110)
b R亨德森,Proc。国家的。学会科学。美国,2013,110年,18037 (DOI:10.1073 / pnas.1314449110)
c M van鞋跟,Proc。国家的。学会科学。美国,2013,110年E4175 (DOI:10.1073 / pnas.1314353110)
d S苏,Proc。国家的。学会科学。美国、2013、110 E4172 (DOI:10.1073 / pnas.1313802110)
e P gleb stolyarov等,IUCrJ,2017,4,678 (DOI:10.1107 / S2052252517010922)











还没有评论