2012年诺贝尔化学奖授予了罗伯特·莱夫科维茨和布莱恩·科比尔卡,以表彰他们对g蛋白偶联受体的研究。Phillip Broadwith着眼于支撑细胞信号传导的分子机制
一些诺贝尔奖的故事始于一个顿悟的时刻,一个将特定研究人员的研究方向转向新方向的顿悟。今年的化学奖却并非如此。
了解和可视化g蛋白偶联受体(gpcr)的复杂性及其对我们身体几乎每个细胞的影响已经花了几十年的时间。这条道路上的步伐有时小得令人痛苦;每一个进步的片段都必须被拼凑起来,直到最终开始呈现出全景。
这需要今年的两位获奖者异乎寻常的热情、承诺和顽强的决心,罗伯特·莱夫科维茨美国达勒姆的霍华德休斯医学研究所和杜克大学布莱恩Kobilka以及他们的许多学生和合作者。
但他们的工作为理解细胞外的信息——以激素、神经递质、药物分子和我们体内无数其他信号分子的形式——如何转化为细胞内的行为打开了一扇门。GPCR蛋白家族非常庞大,已知人类中约有800个,其中约一半是赋予我们嗅觉的嗅觉受体。另一半则对肾上腺素、多巴胺和组胺等信号分子,以及某些脂质和肽激素做出反应。这些分子留在细胞外,但GPCR构象的改变引发了由一系列g蛋白介导的不同内部反应。
一家以gpcr为基础的药物研发公司的首席科学长马歇尔(Fiona Marshall)说,他们所做的是让我们对最重要的一类蛋白质有了全面的分子理解Heptares。“几乎你能想到的每一种疾病,都有一种GPCR可以成为这种疾病的靶标。目前市场上约有40%的药物是通过这一受体家族起作用的。
田野里的父亲
“当你进入这样一个领域时,有些人似乎永远都在这个领域,比如莱夫科维茨——他似乎什么都做过!”说克里斯•泰特他在英国剑桥的医学研究委员会分子生物学实验室(LMB)研究gpcr和其他膜蛋白。“他参与了受体的克隆,并整理了药理学和生物化学。Kobilka从一开始就参与了第一批受体的克隆,所以他们俩都是这个领域的真正之父。”

莱夫科维茨解释了所涉及的步骤,问题的严重性变得清晰起来:开发与受体结合的放射性标记配体,以及标记和跟踪其活性的工具;然后净化第一个受体。他说,这非常困难,花了10年时间。“这不仅需要一种溶解受体的方法,还需要20万到40万倍的纯化——这些蛋白质是真正的质膜微量污染物。”我们在任何时候都没有超过25或50微克的纯受体,因为它很难制造。”
但最终他们获得了足够的纯受体,使它们能够分裂并计算出蛋白质序列。从那里,他们可以得到DNA序列和编码受体的基因,这样它们就可以被克隆并大量表达以结晶。莱夫科维茨说,每一步都遇到了各种各样的技术障碍。在每个阶段都是熊市,这种情况一直持续到现在。
但是一旦最初的分离工作完成,整个gpcr家族之间的密切关系就可以用来寻找相似的序列。莱夫科维茨解释说:“一开始,(除了净化天然受体)没有办法进入。”“但通过获得这些序列片段,我们可以克隆最初的几个受体,然后这些受体就像罗塞塔石碑一样——人们可以使用同源技术,一点一点地扩大这个家族。”
水晶难题
当莱夫科维茨和他的团队专注于破解gpcr功能的生物化学和药理学原理时,参与克隆工作的博士后布莱恩·科比尔卡(Brian Kobilka)开始专注于瞥见它们的结构。
他说:“离开鲍勃的实验室后,很明显,他开始了研究这些受体3D结构的努力。米歇尔布维耶他在与莱夫科维茨一起做博士后时曾与科比尔卡共事,现在在加拿大蒙特里萨大学(University of montracal)研究gpcr。“在他的实验室里,他们所做的几乎所有事情都与获取结构信息有关。”

布维耶解释说,Kobilka最大的优势之一是建立合作关系,利用各个领域的一些顶尖专家,然后将这些专业知识应用于GPCR问题——如何修改蛋白质使其更稳定;如何提纯以获得大量;如何使它们结晶,然后和最好的晶体学家一起得到好的结构。“但他是整件事的幕后推手,”布维耶补充道
他还指出,科比尔卡一门心思的追求,花了大约15年的时间才真正成功地制造出晶体结构,这可能是他失败的潜在原因。“他冒了很大的风险;布维耶说:“有时他失去了很多资金,实验室可能会遇到大麻烦。”“他冒了很大的风险,他能挺过来让很多人都很高兴——布莱恩是一个大家都喜欢的人。”
科比尔卡自己很快就强调了其他人在他前进中所起的作用。他说:“有一个支持我的妻子,她也是我在科学上的合作伙伴,这可能是在事情进展不顺利时向前迈进的最重要因素。”“我也很幸运有很棒的同事、学生和博士后。”Kobilka’s wife, Tong Sun, who trained as a medical doctor, works alongside him at Stanford, and is chief executive of the spin-out company that they co-founded,ConfometRx。
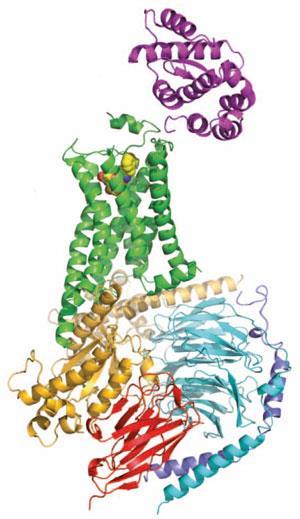
Kobilka的团队用来研究gpcr结构生物学的一些策略已经被证明是非常普遍的。泰特指出,形成受体跨膜部分的特征螺旋之间的一个环在结晶过程中可能特别麻烦,因为它通常相当灵活。用一种叫做T4溶菌酶的酶的序列取代这部分蛋白质已被证明是一个非常成功的策略,并导致了几种受体结构。
但是,尽管自2007年第一个结构的发表以来,Kobilka在结晶gpcr方面一直处于领先地位,但它确实是他的团队的出版物肾上腺素受体与它的g蛋白信号伙伴的复合物,这一点很突出。泰特说:“这正是布莱恩在这个领域脱颖而出的地方。”“我真的不知道会重复多少次,因为这真的很难做到。”
泰特解释说,g蛋白本身,当它们与受体结合时,是非常不稳定的,所以研究小组不得不使用来自骆驼的抗体片段来稳定g蛋白三个亚基之间的界面,以使其结晶。他说:“这确实首次展示了激活的GPCR是如何激活g蛋白的。”
这只是故事的一半
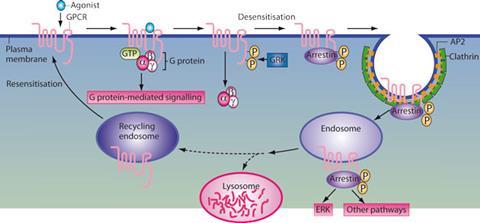
如果g蛋白信号是gpcr激活的唯一途径,那仍然是了不起的。然而,仅仅关注g蛋白会忽略受体生物化学的一个重要方面。当激活时,GPCR与g蛋白相互作用。莱夫科维茨解释说:“它还会在多个位点磷酸化,从而导致β -抑制蛋白的结合,并关闭g蛋白的信号传导。”这也是受体对刺激变得不敏感的机制——即使细胞外信号分子的浓度仍然很高,在几分钟内g蛋白的活性就会停止。
但是Lefkowitz和他的团队发现-抑制素也可以触发它们自己的信号通路。它们不仅可以关闭g蛋白信号,还可以激活完全独立于g蛋白的信号级联反应,或者涉及g蛋白和抑制蛋白的组合。
莱夫科维茨还开始发现可以选择性地开启这些途径中的一种或另一种的分子,即所谓的“偏置”配体。意识到可能的药理意义后,他成立了一家名为Trevena和他的几个博士后一起进一步研究。
进行业
创始博士后之一、现为Trevena生物部门负责人的乔恩·维拉琴(Jon Violin)解释说,该公司使用专有的检测方法来筛选有选择性地开启一种或另一种途径的化合物。他们用经典的迭代药物化学方法来提高它们的选择性和效力,并发展结构-活性关系来指导进一步的研究。
小提琴解释说,在某些疾病中,预期的医疗效果与一种途径有关,而副作用主要由另一种途径引发,因此偏配体将是一种更好的药物。比如,特雷维纳有一种化合物叫做TRV130该药物以阿片受体为靶点,选择性地只激活g蛋白通路。“像吗啡这样的阿片类镇痛药有很多副作用,”小提琴说。“它们会导致呼吸抑制(过量服用会导致死亡)、胃肠道功能障碍——恶心、呕吐、便秘——显然它们也会上瘾。”
小提琴说,在缺乏-抑制素通路的老鼠身上进行的试验表明,大多数副作用是由-抑制素信号介导的。“因此,如果你能找到一种在镇痛效果上模仿吗啡的药物,我们知道它是由g蛋白偶联介导的,但避免了β -抑制素,那么你可能会有更好的药物。”这就是我们在TRV130中发现的——在临床前研究中,它是一种非常强大的镇痛药,可以减轻呼吸抑制和便秘。”
但小提琴也指出,有时情况完全相反。另一种特里文纳化合物,TRV027,选择性地打开血管紧张素受体的-抑制素信号。这个项目的灵感来自血管紧张素受体阻滞剂(ARBs),它被广泛用于控制高血压(高血压)。他解释说:“当有人服用ARB时,我们知道它通过阻止血管紧张素与受体结合(从而阻止g蛋白活性)而具有临床益处。”“但arb也能阻止血管紧张素开启-抑制素通路,其中一些是有益的。”
我们在虚拟筛选、药物设计和铅优化中使用这些结构
结构数据也在指导开发新的更好的靶向一系列gpcr的药物。“如果你在制药行业,你想知道你感兴趣的每一个GPCR的结构,最好是有不同配体结合的多个结构,因为你对如何改变这些配体来影响疗效或选择性感兴趣,”Tate说。
这正是英国公司Heptares正在尝试做的事情。这家公司是由剑桥LMB的一群科学家(包括泰特)创立的。马歇尔说:“我们已经开发出了自己的方法来获取gpcr的x射线结构,这与布莱恩·科比尔卡(Brian Kobilka)所采用的方法略有不同。”“这涉及到对蛋白质进行工程改造,使它们更稳定,这样它们就不依赖于膜环境。””This means the proteins can be isolated, purified and used in fragment screening for drug discovery, or crystallised to determine their structures. ‘We’ve got a large number of structures now, and we’re using those structures in virtual screening, drug design and lead optimisation,’ says Marshall. ‘We’ve been able to use the knowledge of the structures to actually get selectivity where that hasn’t been possible before.’
Tate认为,GPCR结构生物学从纯学术到工业环境的转变标志着一个转折点。他说:“业界通常对这类具有挑战性的项目相当保守,但现在已经有人这么做了,这真的很令人兴奋。”
再次在一起

莱夫科维茨和科比尔卡都对未来充满热情;事实上,这两个团队最近又开始合作了。合作的一部分是试图结晶血管紧张素受体,正如Lefkowitz解释的那样,这突出了一个事实,即尽管Kobilka引入的许多技术都是相当普遍的,但仍然不能保证成功的结构。“我们已经合作了3-4年,但就是行不通。他说,我们已经试过了所有能想到的方法。“这太棒了,因为我们有完全偏向g和完全偏向β -抑制蛋白的配体,但我们就是不能结晶这该死的东西!””
另一个目标是解决与β -抑制素耦合的gpcr结构。Kobilka说:“关于特定的gpcr如何与特定的g蛋白亚型结合,以及与其他信号和调节蛋白结合,我们还有很多需要了解的。”“其中一些问题可以用晶体学来回答;然而,将所有功能相关的相互作用结晶化可能是不可能的,所以我们需要应用其他生化和生物物理方法。”
破译g蛋白奥秘的斗争远未结束,毫无疑问,未来将面临重大挑战。对科比尔卡来说,这是最大的动力之一。他说:“我相信大多数科学家喜欢解决难题的过程,就像喜欢实现目标一样。我们经常从失败中学到一些东西,帮助我们继续前进。”
家庭事务

在与莱夫科维茨的交谈中,很明显,今年的诺贝尔奖不仅表彰了伟大的科学,也表彰了伟大的导师。世界上很多顶尖的GPCR研究人员都曾师从Lefkowitz、Kobilka或两者。莱夫科维茨解释说,在他的职业生涯中,他越来越意识到导师的重要性。说到指导,就像其他事情一样,你必须发挥自己的优势。我知道布莱恩被认为是他的学生和同事的好导师,但他的性格和我的性格截然不同,所以我们不可能以同样的方式进行指导。但这并不意味着我们不能成为很好的导师。
莱夫科维茨补充说:“我性格的一部分是,对我来说,我的实验室就像第二个家。”“我喜欢揣摩别人,揣摩他们的潜力。然后,我几乎把它作为一个个人挑战,看看我是否能让每个人,至少在他们和我在一起的时候,看看在他们最好的活动水平下工作是什么感觉。你必须根据不同的人的天赋,以不同的方式与他们共事。
“事实上,我和布莱恩分享这个奖项,比我单独获得这个奖项,或者和其他没有和我一起训练的人分享这个奖项要好得多。”他说,这感觉太完美了。










暂无评论