这对行业和未来的药物审批来说是个好消息,但医生们怀疑它对大多数患者是否有效
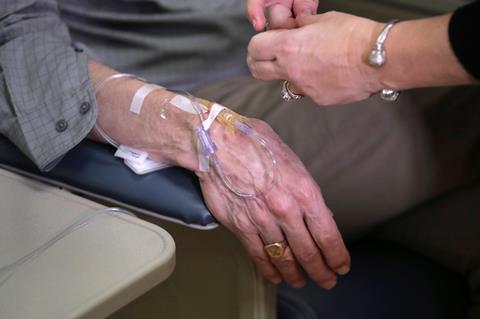
美国食品和药物管理局(FDA)批准了Biogen公司的aducanumab(现在称为Aduhelm),这让阿尔茨海默病界感到惊讶。FDA指出,这种单克隆抗体是第一个显示阿尔茨海默病患者大脑中淀粉样斑块减少的单克隆抗体。以前的药物减缓了这些异常蛋白团块的发展,但没有减少它们,这是阿尔茨海默病的标志。
美国政府批准了“加速批准”,旨在为那些需求未得到满足的严重疾病提供更早获得潜在有价值的疗法,以及“尽管存在一些剩余不确定性,但仍有临床获益预期的疾病”。帕特里齐亚·卡瓦佐尼指出他是FDA药物评估与研究中心的主任。
这种不确定性部分归因于该药物的两项三期临床试验将于2019年停止一项中期分析显示没有临床益处。后来,当对更多数据进行分析时,其中一项试验中的一组患者表现出了改善。这是对数据的回顾和事后分析去年末未能打动独立顾问团。事实上,该委员会至少有三名成员已经辞职,以抗议批准这一决定。
我以为他们会要求提供更多的数据,或者有条件地批准
FDA指出在所有试验中,淀粉样斑块都减少了,并得出结论,这有可能导致临床获益。但只有一项试验显示出临床益处。阿尔茨海默病研究人员的反应大相径庭。他说,我原以为他们会要求提供更多数据,或者获得某种有条件的批准约翰·哈迪来自英国伦敦大学学院。
哈迪补充说:“他们有一个积极的试验和一个绝对没有结论的试验。”“它在达到次要终点(淀粉样蛋白减少)后被批准,这真的很不寻常。”他预测,如果清除淀粉样斑块被用作阿尔茨海默病药物的替代品,就像降低胆固醇是心脏药物的一个标志一样,将会遭到许多研究人员的强烈反对。
哈迪在同事中看到的一些评论是这样的:“我不认为大脑中的淀粉样蛋白是一种疾病。我以为是痴呆症然而,人们意见不一。神经学家说:“坦率地说,替代物(淀粉样斑块)是一个奇怪的称呼,因为它是导致患者记忆衰退的原因。丹尼斯·阿兹她对FDA的决定表示欢迎。
神经系统科学家托马斯Wisniewski他表示,虽然对这一决定感到惊讶,但他支持批准。他欢迎淀粉样蛋白减少作为替代标记,“因为它增加了其他药物也被批准的可能性。”不过,他也承认,对于有症状的患者,靶向斑块本身是否是一种可行的治疗方法,他持怀疑态度。
Wisniewski立即通知他的病人,虽然Aduhelm是一个里程碑式的成就,但它并不能治愈阿尔茨海默病,临床疗效仍不确定。它的批准并不局限于早期疾病,如何选择患者进行治疗仍有待观察,这需要每四周静脉输注一次。
Aduhelm的目标是阿尔茨海默病的早期阶段。但是Wisniewski说,在美国,检测早期淀粉样斑块的扫描通常需要5000美元,而大多数美国健康保险公司不包括他们。哈迪同意说:“找到病情轻微的病人很难,而且告诉病人他们已经病入膏肓,这种药物已经不起作用了,也很难。”他指出,仅英国就有50万阿尔茨海默病患者。他补充说,这种药物对他们可能不会有效,而且可能会使这个国家破产。如果英国监管机构跟进并获得批准,英国国家健康与护理卓越研究所(National Institute for Health and Care Excellence)也将在向患者提供该药物之前进行成本效益计算。
阿尔茨海默氏症协会等患者团体为获得批准而奔走欢迎FDA的决定。病人的压力将是巨大的。维斯涅夫斯基说,他已经收到了“无数的电话和短信”,这就是对治疗的被压抑的需求。但在许多患者中,这种疾病会发展得太严重。Selkoe说,FDA应该只批准轻度或非常轻微的认知障碍患者使用。他补充说:“根据标签,任何患有阿尔茨海默病的人都可能服用这种药物。”这对我们从业者来说更具挑战性。”
他并不是唯一持这种观点的人。哈代说:“我很惊讶,这种认可似乎如此广泛。”“人们可能希望FDA如此积极的原因是因为他们有我们没有从继续接受药物的人那里看到的数据。塞尔科认为,“FDA可能受到了目前正在进行临床试验的另外三种抗体制剂(来自卫材、礼来和罗氏)的影响,其中一些已经公布了积极的结果。”
找到症状轻微的患者很困难,而且告诉患者他们已经到了这种药物不起作用的晚期,也很困难
哈佛大学(Harvard University)神经科学家鲁道夫•坦齐(Rudolph Tanzi)说,作为一名医疗专业人士,我对这项批准的后果感到担忧,因为从大脑中去除淀粉样蛋白并不能改善认知能力。“作为一名科学家,我很高兴。他解释说,这是因为美国食品药品监督管理局(FDA)现在已经开启了去除淀粉样蛋白药物的临床试验的大门,这将更安全、更便宜,因此可以在患者出现任何疾病症状前几年就对他们进行治疗。
坦兹说:“我们一直在为如何让淀粉样蛋白药物进入试验而烦恼,如果FDA希望它们改善认知能力,而他们不会这么做。”他认为Aduhelm最适合那些在出现任何症状之前就能负担得起扫描的人,然后再负担得起作为预防药物的药物,在淀粉样蛋白引发神经炎症和脑细胞死亡之前去除淀粉样蛋白。
生原体指出在3000多名至少接受过一次剂量的患者中,Aduhelm的安全性“非常明显”。然而,Wisniewski说,需要频繁的监测扫描,以确保药物没有严重的并发症,比如“淀粉样蛋白相关的成像异常”,这可能是脑肿胀或出血的信号。
FDA的卡瓦佐尼写道,该机构将继续监测Aduhelm,因为它到达患者,并要求批准后的临床试验。Selkoe希望在Aduhelm未获批准的国家进行安慰剂对照试验。这可能会导致该药物从市场上撤下,如果它没有被证明有效的话。日本、欧洲和巴西的监管机构正在考虑这种药物。










暂无评论