美国和欧洲的监管机构正在引领全球协作确保边境以外的药物是安全的
的美国食品和药物管理局(FDA)发布了计划以确保美国公民继续享受获得安全的药物,尽管全球化的监管压力增加。FDA的全球接触报告概述了一个转换,将改变国内公共卫生机构全球。当地监管部门的计划包括建立联盟一个健壮的全球产品的安全网。这将有助于提供更广泛的活性药物成分(API)生产监控来满足对质量的需求,在发达国家资金效益的药物。但这些措施已经会见了警告,他们可能会妨碍增长的活性药物成分(API)工业和发展中国家使它更难以获得安全的药物。
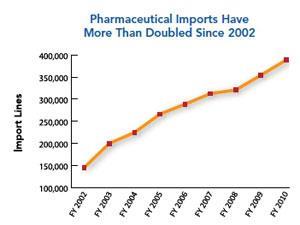
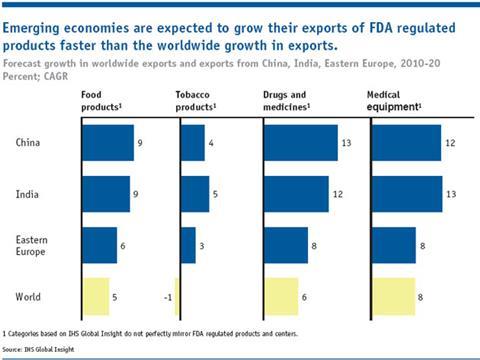
国际监测已经显著的工作后基本API制造业转移到亚洲,尤其是中国和印度。美国食品和药物管理局估计,从2005年到2011年美国进口医药产品已经翻了一倍。它还预测,印度和中国的本地制药产值在2012年将两个半倍是在2006年。中国已经拥有最多的FDA-registered药品生产企业在美国以外的国家,紧随其后的是印度。印度已成为一些药物的最大生产国,如乙胺丁醇、雷尼替丁和磺胺类药,”迪利普沙,印度制药联盟的秘书长,告诉化学世界。必威体育 红利账户是生产原料药和中间体不仅为通用的行业,而且品牌行业的产品专利保护了十多年。
虽然这些国家提供低成本的产品,西方药品监管机构如FDA迫切希望确保这不会为代价的不符合良好生产规范(GMP)和API。全球的api规范使用统一标准称为我迄今为止,“FDA发言人莎拉Clark-Lynn解释道。然而,一些国家将api只是作为另一种工业化学品。即使在国家承认我迄今为止是否有显著差异或API如何网站进行检查,这可能导致问题的规定API国际运输和使用。一个API的质量决定了部分的完成药物的安全性和有效性取决于消费者。与其他组件一样,全球制造业和监管社区需要保持警惕。”
获得进入美国或欧盟市场,外国制造商的设施目前首先必须检查和FDA批准的或欧洲药品局(EMA),分别。作为药品生产转移到亚洲,监管机构的任务增加,生产和质量主管David Cockburn说合规教育津贴。无论是api或成品更加困难的时间和易于访问欧盟监管机构监督生产活动在地理上遥远的地点相同程度的国内制造业,”他说。所以有更多的强调进口商履行义务,在不同程度上对当地监管控制、与其他国际监管合作伙伴。当地政府的终极目标必须能够监督当地活动对国际商定的标准。
建筑法规
普遍可信赖的当地法规还有一段路要走,弗雷德里克·阿伯特指出,国际法律和医药政策的专家和监管在佛罗里达州立大学,我们。目前的问题是,印度和中国历史上没有大量投资于国内的监管能力,需要暂时关注改善领域,”他说。在这方面,EMA和FDA首先需要与印度和中国政府在提高国内监管能力。才会真正的合作关系是可行的依赖的感觉。毫无疑问,印度和中国是足够的技术专长的学生毕业,需要员工操作。是一个重要的资源建立国内机构。”
检查负担目前仍然落在发达国家食品和药物管理局(FDA)这一挑战。FDA正在增加检查的外国生产地点和工作像药品检验的组织与全球合作计划为API开发严格的检验标准网站,“Clark-Lynn解释道。我们建立了13个外国文章在10个国家,包括印度和中国,为了提高全球药品质量。但即使有了这些资源,与其他国家合作仍然是一个至关重要的美国机构的计划的一部分,她说。“FDA不可能到处都是所有的时间,我们依靠强劲的来源国家的监管系统检查API网站”。
无论植物生产药物授权为欧洲和美国市场位于世界,它已经由EMA和FDA分别Cockburn和Clark-Lynn强调。然而,地区之间团队合作使得更多的定期检查,并提供设施管理在一个地区的知识但尚未授权在另一个。FDA和EMA因此近年来合作,共享工厂检验报告和寻求更好的理解彼此的检验实践。与日益增长的在这一领域的国际合作,我相信网站的比例感兴趣的多个地区,已经检查可能是远高于一般认为,“Cockburn说。
有害的副作用
沙阿说,FDA已经调节在印度超过200株。它的文档路径和严格的检验制度处罚失败作为不符合的主要障碍,”他补充道。但监管的成本传递到病人,削弱储蓄在亚洲发达国家接收从制造业。影响将最大体积小和低价值的药物,将使中小企业很难竞争。
Cockburn说不合适的重点可以放在合规成本。“GMP合规与质量保证和风险管理原则是对公共健康的保护,”他指出。不过,它也促进良好的商业实践通过第一次把事情做对,减少质量变化从而提高效率和维护商业信誉。
然而,雅培突显non-GMP兼容公司准备从那些业务。这是昂贵的建造工厂和雇佣人员必须保持较高的监管标准,”他说。”在印度主要API制造商,致力于投资质量和公司似乎能够吸收费用和在全球市场的竞争力。然而,中国API生产商似乎削弱了印度的价格。”
沙也表明,符合GMP和质量标准在技术上是可以实现的,一些发达国家规定实际上是“非关税壁垒”API进口。他指出,欧盟的2011年6月伪造药品指令和FDA收集的用户费用的从药物生产商加快审批流程为例。Shah说,如果发达国家想要降低医疗支出,它应该使用协作来简化监管监控流程。这将鼓励,而不是打击,新球员的条目,从而促进竞争力量降低药品的成本,”他说。
与此同时,阿伯特指出,大多数国家没有机构EMA和FDA海外执行标准。由于这个分叉国际监管结构,构建-,因此患者在外部监管能力较弱的国家面临更大的风险,”他说。从构建我的讨论和API生产商在发展中国家,这是一个重大的问题。
安迪Extance









还没有评论