弱相互作用稳定β-sheets和可能有助于理解疾病,如阿尔茨海默氏症
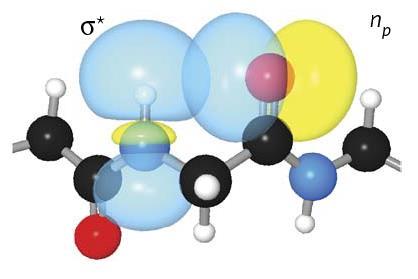
氢键错过了几十年来似乎发挥重要作用在稳定蛋白质的二级结构,尤其是β-sheets。尽管它的弱点,这个键是常见的足以产生累积影响稳定的典型的蛋白质,特别是相关的神经退行性疾病如阿尔茨海默氏症。理解这些交互发展关键是可靠的计算方法,模型的3 d序列的蛋白质结构。
人们一直在关注的结构蛋白骨干几十年来,[…]但我们仍然不欣赏所有的化学相互作用发生,”说罗伯特·纽贝里,在美国威斯康辛大学麦迪逊分校的研究员和这篇论文的作者之一。我们发现第二个交互的骨干α-helix似乎补充规范的氢键被几十年来,但没有意识到类似β-sheets交互。这激发了我们的工作,特别是因为这些二级结构与蛋白质错误折叠的疾病(如阿尔茨海默氏症)。
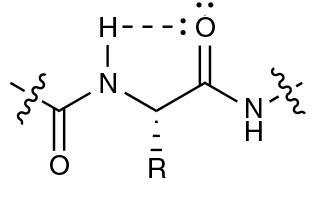
氢键的形成酰胺质子和羰基氧之间的相同的氨基酸。我们团队研究了氢键,被称为C5,使用大量的计算和实验技术。调查的一个意味着债券涉及创建工程改良肽形式较弱的氢键。研究人员发现,这些新的肽更不稳定,显示变性温度25°C低于天然结构。根据纽贝里这种交互可能被忽视了,因为“失败的一些标准经典氢键:它不是线性的,因此大多数计算机程序不承认的。然而,使用计算计算,“你可以看看分子轨道,看到这个C5债券是可能的,Newberry补充道。
盖尔·巴特利特生物信息学研究布里斯托大学英国认为蛋白质是非常复杂的系统,和理解这些非共价相互作用之间的相互作用还远未完成。不过,我相信这个新工作非常重要,将会导致提高力场和得分函数预测模型。”Bartlett指出,“这是第一次研究了C5交互在蛋白质的背景下,在解决方案”。
新的计算方法将允许研究人员更好地预测蛋白质的结构可以测序,但不能被孤立或结晶。”包括的C5氢键等相互作用计算计算将提高研究人员的能力来设计新模型,最终,新药抗神经退行性疾病、“Newberry总结道。
引用
W Newberry和R T雷恩斯,Nat,化学。医学杂志,2016年,DOI:10.1038 / nchembio.2206










还没有评论