保罗Docherty奇迹的游行错综复杂的激进反应
一次又一次,中药出现新的生物活性天然产物。通常产地和有效性已经建议,加快寻找活性成分和缩小的列表组件分离。
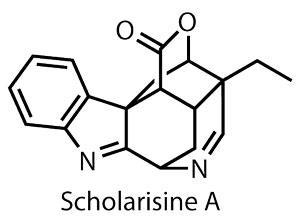
Scholarisine吗?就是这样的一个物种,发现从2008年的传统治疗呼吸道疾病,但不是单独分析生物功效。1然而,已经合成的挑战是显而易见的,复杂的笼形结构轴承几个三级和四级中心。
这不是全新的领地——领导的一个团队阿莫斯史密斯美国宾夕法尼亚大学的一个简洁但冗长的合成scholarisine完成去年。2但在25的步骤,当然还有空间斯科特•施奈德纽约哥伦比亚大学和麦尔斯史密斯去改进它。3
团队产生enone亲二烯体手性oxazolidine戒指源自于氨基酸d-serine。使用一直Diels-Alder环加成作用(图1)和不同寻常的环二烯(甲基coumalate),他们建立一个整洁的双环中间体,轴承内部烯烃和一个环外的羰基在有用的地方。几何oxazolidine控制反应,被破开之前有点酸,和显示终端与溴羟基取代。
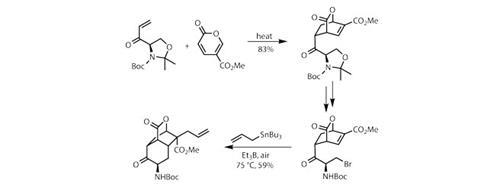
然后设置第一阶段三个自由基有着不成对的电子的化学反应——包括短暂的中间体。生成自由基,团队使用triethylborane在空气气氛(图1)。硼烷与分子氧反应彻底,然后被撕掉,溴原子,使一个烃基,立即关闭到二环enone形成另一个六元环。由此产生的激进的中间反应的烯丙基锡烷解决三环的烯丙基集团的核心。这有点生硬的方法允许团队构建一个非常拥挤的第四纪中心良好的立体选择性和收率。
这迅速进步之后,团队面临着一个棘手的问题。伯胺的立体化学需要倒。通往这个目标越明显(deprotonating质子)被竞争副反应挫败。然而,胺是倾向于激进的氧化,形成一个amino-enone。团队利用这个特性通过氧化胺四甲基胍(TMG)和稳定的激进的氧化剂节奏(2,2,6日6-tetramethylpiperidine -N-oxyl)。产品团队公开amino-enone deprotection-reduction-cyclisation序列,生成一个六元环内酰胺,完成scholarisine的笼形结构的关键。
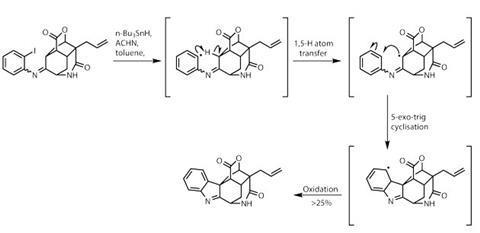
戒指的难题,但也有几个。冷凝的酮2-iodoaniline添加所需的芳基环,第二个激进的级联(图? 2)。碘提供了一种简便的网站形成一个芳基激进,摘要一个氢从附近的笼系统。,回芳基环烷基然后攻击,被氧化形成之前吲哚组中发现的目标。这个非传统的过程的总收率较低,但操作上非常有效,所以一些转换产生巨大的复杂性。
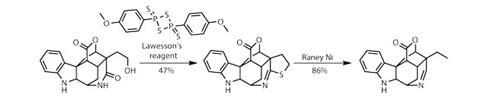
与目标仍然几个步骤,把剩下的末端烯烃与臭氧减少的条件下提供一个终端羟基,但也降低了吲哚二氢吲哚。用酒精处理,团队指导fearsome-smellingLawesson试剂cyclise到内酰胺羰基,产生一个四氢噻吩环(图3)。这看起来可能不富有成效,但裂开兰尼镍揭示了乙的硫原子侧链和亚胺的功能目标。最后,一个小氧化iodosobenzene恢复吲哚,完成一个惊人的合成scholarisine只有14个步骤。
Docherty保罗是一个基于科学作家在莱顿,荷兰











还没有评论