安东尼·金发现,在经历了一些广为人知的问题之后,基因疗法——利用病毒将DNA送入人体细胞——正在蓬勃发展
基因疗法在临床试验中日益显示出前景。研究人员说,患有严重疾病的儿童已经改变了他们的生活,但外界几乎没有注意到这些成就。
基因疗法将基因传递给病人,病人要么错过基因,要么基因有缺陷,而传递载体(载体)几乎总是病毒。这一领域在20世纪80年代和90年代饱受炒作之苦,但最终为患者带来了成果,尽管数量很少。“这几乎就像公众意识与基因治疗的成功成反比,”他说西蒙沃丁顿他领导着一个专注于基因治疗临床前模型的团队。“就连科学家也不知道这些疗法有多有效。”
由单一基因缺陷或缺失引起的许多代谢疾病,通常在儿童早期致命或使人衰弱,是临床试验的重点。“我们已经开始看到很多行业参与基因治疗,这通常是事情进展顺利的一个迹象。”与五年前相比,这个领域的感觉已经大不相同了。史蒂文灰色他是美国北卡罗来纳大学的基因治疗师。在过去的五年里加速的进展是对矢量的基础研究。针对两种主要类型的病毒,有两种不同的策略。意大利米兰圣拉斐尔基因治疗研究所(San Raffale Telethon Institute for Gene Therapy)所长、遗传学家路易吉•纳尔迪尼(Luigi Naldini)说:“我们看到的是新一代载体带来的回报。”
去除,修复,再注入
溶酶体是我们细胞内含有43种酶的囊,每种酶可以分解某些分子。溶酶体储存病(lsd)是由一种基因突变引起的,该基因突变导致一种必需酶功能失调;目标分子聚集并在多个器官和组织中引起问题。
我们正在为临床试验做准备
Brian Bigger,曼彻斯特大学
这些疾病被认为是基因治疗的理想靶点。纠正患者某些细胞中某个基因的缺陷可能是革命性的,因为分泌缺失酶的一小部分细胞可以纠正这种缺陷。自20世纪80年代以来,一些LSD患者接受了骨髓移植。在传统的治疗过程中,化疗药物杀死骨髓细胞,为没有缺陷基因的捐赠者的干细胞腾出空间。这些细胞分泌缺失的蛋白质。
基因疗法遵循类似的策略,除了使用一种药物来诱导患者自己的干细胞进入血液,在那里它们被过滤掉。这些细胞被培养,然后用逆转录病毒或慢病毒感染,使其变得无害。“慢病毒载体整合到基因组中,用这些细胞表达转基因或缺失基因,”解释说布莱恩更大在英国曼彻斯特大学。然后将病人改变过的干细胞注射回他们体内。他的实验室使用慢病毒将一种基因传递到圣菲利波病(MPS-IIIa)的小鼠模型中,这是一种溶酶体储存疾病。比格说:“我们正准备与我们授权的Orchard Therapeutics公司进行临床试验。”近几十年来骨髓移植的进展极大地帮助了这种疗法。
在米兰,圣拉斐尔基因治疗研究所(San Raffale Telethon Institute for Gene Therapy)治疗异染性脑白质营养不良(MLD)儿童,这是一种致命的疾病,涉及有毒脂质的积聚,目前还没有批准的治疗方法。这种毁灭性的疾病会导致儿童在两岁时丧失语言能力和行动能力,然后患上失明、消瘦和痴呆;这些孩子大约在5岁时死亡。米兰的成绩给该领域的人留下了深刻的印象。“这种治疗方法是革命性的,”比格说。“他们现在有四年的数据:所有的患者都上学,智商正常,运动功能正常,只要他们在症状出现前接受治疗。”
戳破泡沫
值得注意的是,从慢病毒获得基因后,干细胞穿过血脑屏障被放回患者体内:在患者的脑脊液中测量到正常的酶水平。米兰研究所所长纳尔迪尼说:“如果我们足够早地找到这些孩子,我们就能阻止疾病的恶化,我们治疗过的孩子现在基本上都很健康。”“基因疗法的优势在于我们使用患者自己的细胞。纳尔迪尼的研究所发现,高达90%的干细胞从载体中获取了基因。1主要优点包括没有移植物抗宿主病或移植排斥的风险。此外,并非所有患者都有合适的移植供体。纳尔迪尼还使用慢病毒治疗维斯科特-奥尔德里奇综合征患者,这是一种严重的联合免疫缺陷病(SCID)。2
就我们销售基因疗法的承诺而言,这只是一个开始
葛兰素史克公司
scid被称为“气泡婴儿疾病”,因为儿童有时必须保持在无菌环境中。1990年,4岁的Ashanthi DeSilva是第一个接受逆转录病毒载体的患者;她接受了自己的t细胞的输注,这些t细胞中有缺陷基因的健康副本。她活了下来。并非所有的早期疗法都有效,由于逆转录病毒打开了癌症基因,存在安全问题。早期版本整合到基因组中,两端有基因启动子(称为长期重复序列或ltr)。如果病人很不幸,这个启动子打开了附近的癌基因,病人就会患上白血病。Bigger最近的一项调查显示,99名接受这些载体的患者中有12人患上了白血病,其中2人死亡。
新的病毒敲除自己的lts,并依赖于哺乳动物的启动子。“在这些更新的、自我灭活的载体中,有35名患者接受了治疗,没有插入突变的病例,”Bigger说。启动子可以根据需要的表达类型进行选择,可以是中度表达,也可以是高度表达,也可以是组织特异性表达。此外,这些“第三代”慢病毒载体更喜欢在有基因而不是启动子的地方整合。大多数慢病毒都来自HIV-1,但只有一小部分基因组被用于制造载体。纳尔迪尼说:“从一种致命而可怕的人类病原体开始,它们被广泛改造,以去除病毒进入细胞所不需要的所有基因和序列。”
葛兰素史克(GlaxoSmithKline)已经批准了这种治疗MLD的疗法,可能在明年上市。GSK发言人说,就我们销售基因疗法的承诺而言,这只是一个开始。“我们认为这是一个未来的平台,可以站在疫苗、生物制药和小分子之外。“在英国,果园疗法正在使用慢病毒载体将腺苷脱氨酶(ADA)运送到体外ADA- scid患者的细胞中。到目前为止,在美国和英国接受治疗的30多名患者中没有出现基因突变的问题。“单基因代谢障碍是显而易见的起点。我们知道这些缺陷的生理原因。西奥多·弗里德曼他是美国加州大学圣地亚哥分校的基因治疗先驱。他说,研究罕见的孤儿病总是能学到很多东西。
GSK将他们的离体工作视为一个学习过程。GSK基因疗法科学顾问乔纳森·阿普尔比(Jonathan Appleby)解释说:“培养一大批可以制造慢病毒载体的细胞非常复杂,因为它想杀死你培养它的细胞。”目前,该公司所有的基因治疗载体都是在圣拉斐尔研究所(San Raffaele institute)毗邻的一个设施中制造的,患者必须前往那里进行细胞修饰。“从质量、时间和成本的角度来看,矢量制造都具有挑战性。我们正在努力扩大它的规模。”
进入身体
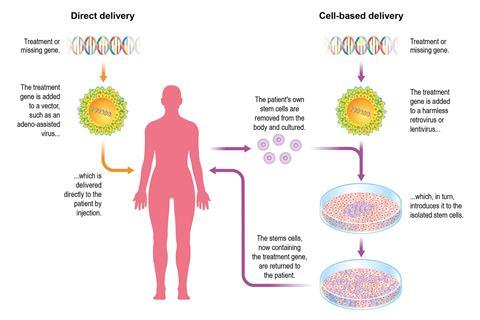
第二种治疗策略是输入病毒载体,寻找靶细胞,并在患者体内传递一种基因。这种方法可能只需要一针就能治愈致命的疾病。然而,一个臭名昭著的悲惨案例标志着活体策略。1999年,19岁的杰西·盖尔辛格在美国的一项试验中接受了基因疗法治疗他罕见的肝病。他死于器官衰竭,可能是由于对腺病毒载体(普通感冒病毒)的极端炎症反应。在这一领域工作的人熟悉病人的死亡以及导致死亡的错误。
“每一个基因治疗试验都被要求报告他们的数据,有大量的负面数据没有被报告,”Bigger回忆道。这一悲剧使美国基因治疗试验停滞了10年。现在,由于人们重新关注患者安全,一些人在这种停顿中看到了一线希望。格雷说:“为了真正了解基本生物学和载体系统,我们投入了大量资金。”“在过去的五年里,我们看到了基因疗法的复兴,一些悄无声息的临床成功增加了人们的热情。”
腺病毒不再受欢迎。相反,研究人员尝试了不会引起人类疾病的腺相关病毒(aav)。aav将治疗基因传递到细胞核中,但环状DNA随后位于染色体之外。由于aav通常不会整合到细胞的DNA中,这降低了患者DNA突变的风险(称为插入突变)。
从眼部疾病开始,aav在体内修复基因方面处于领先地位。据预测火花疗法将成为FDA批准的首个基因疗法。去年,该公司报告称,在一项III期试验中,29名遗传性视网膜疾病患者中有27人在治疗一年后视力有所改善。弗里德曼说:“这些孩子注定会失明,但治疗使他们的一些功能性视力得到了显著恢复。”Spark使用AAV载体将基因传递到视网膜细胞;该公司还开始了临床试验,旨在向血友病a和B患者的肝脏输送一种基因。
以大脑为目标
2015年,Gray的研究导致了一项治疗巨型轴突神经病(GAN)的临床试验,使用AAV载体递送了一种gigaxonin基因。GAN症状始于儿童早期,最初表现为行走困难,恶化后包括瘫痪、癫痫和痴呆。GAN研究由汉娜希望基金,由塞姆斯家族于2008年创办(他们的女儿汉娜患有这种疾病)。格雷说:“我们使用AAV9是因为它可以穿过血脑屏障。”“我们通过静脉注射或进入脑脊液中,使其集中在大脑和脊髓周围。众所周知,它的目标是大脑中的神经元和星形胶质细胞。“AAV9与血脑屏障外的受体结合,并被引导通过。
对人类和非人类灵长类动物的研究已经发现了100种AAV变体,它们现在是体内基因治疗的主力。有些可以靶向特定的组织,AAV8是肝脏的载体,AAV9是中枢神经系统疾病的载体。生物技术公司Avexis在他们的脊髓性肌营养不良试验中使用了AAV9。Avexis的首席科学官布莱恩·卡斯帕(Brian Kaspar)说:“我们的重组AAV9衣壳将人类SMN(运动神经元存活)基因的功能副本通过血脑屏障传递到患者自身的细胞,而无需修改患者现有的DNA。”不整合到DNA的缺点是,如果细胞分裂,基因就会丢失,这使得它不适合快速分裂的细胞,如骨髓、皮肤和肠道细胞。慢病毒通常是这类细胞的选择。然而,神经元的寿命非常长,所以在针对大脑时,不整合不是一个问题。
一次性静脉注射AAV9也是治疗的策略Abeona疗法圣菲利波综合征的基因治疗试验。而Lysogene在欧洲使用一种非人类灵长类AAV,命名为rh.10。Lysogene首席患者获取官萨曼莎·帕克(Samantha Parker)解释说:“(aav)已经成为中枢神经系统最常用的基因治疗载体,因为它们安全、无致病性,能够感染体内的分裂细胞和静止细胞,尤其是神经元。”研究人员将载体直接注射到四名患者的大脑中,这些患者的行为和睡眠障碍都有所改善。该公司计划进行第二阶段试验,但使用一种新的启动子,帕克说这种启动子可以使酶的表达增加三倍左右。
提高效力和针对性
“在过去的四五年里,这些技术的效力呈指数级增长,”沃丁顿说。他将AAV载体用于血友病B的临床前工作向前推进。在2010年至2012年期间,伦敦大学学院癌症研究所的Amit Nathwani和美国田纳西州圣裘德儿童研究医院的同事们成功地向10名患有严重血友病的男性注射了AAV8载体,以传递一种对凝血至关重要的IX因子转基因。这导致了缺失因子在治疗水平上的长期表达,这是第一次。肝细胞是长寿的蛋白质工厂,很容易将其产物释放到血液中。
Waddington说,这些成功建立在更好的病媒定位和效率的基础上。他回忆道:“我记得2007年前后在老鼠身上进行注射时,发现它们表达了3000%的人因子IX。”“当时人们认为基因疗法已经衰落,但我们这一领域的研究人员被我们所看到的进展所激励。”
一般来说,Crispr-Cas9和基因编辑在纠正疾病时可以给我们更高的精度
路易吉·纳尔迪尼,米兰圣拉斐尔学院
不同的aav变体会进入不同的组织,研究人员会调整病毒以细化它们的靶向性。“你可以使用不同的外套蛋白有效地针对大脑、肝脏或肌肉,”Bigger解释道。格雷的实验室通过尝试不同的组合来调整aav周围的衣壳蛋白。“一个氨基酸的差异就能改变AAV的有效性,”他说马克·凯他是美国斯坦福大学的基因转移技术专家。“我们和其他人正在使用多个aav构建衣壳基因文库,然后将数百万个变体进行进化选择。“然后通过将人类肝细胞放入人化小鼠模型中进行测试,寻找靶向性最好的肝细胞。”一种由五种不同的亲本AAV衣壳组成的嵌合衣壳被证明比AAV8更有效地将转基因基因传递到人类肝细胞中。3.
凯创立了一家公司,“航行者”号疗法该项目旨在将aav直接注射到大脑中,治疗患有严重中枢神经系统疾病的患者。它有亨廷顿病、阿尔茨海默病和单基因肌萎缩性侧索硬化症(一种进行性致命的神经退行性疾病)的临床前阶段候选患者。Voyager的主要候选药物用于治疗晚期帕金森病,目前正在对5名患者进行试验。改善病毒载体的其他方法包括在AAV载体内复制两个副本。
但问题依然存在。通常情况下,10%到40%的人对AAV变体有特异性免疫,并产生抗体。目前,对特定血清型产生抗体的患者没有使用这种病毒载体进行治疗,当病毒载体不能简单地改变时(这是治疗的一部分,需要得到监管机构的批准),就出现了一个问题。“在未来,我们也许可以通过免疫抑制或使用某种味道的耐受机制来解决这个问题,但目前这是一个局限性,”比格承认。
Sangamo疗法在临床试验中使用AAV病毒将锌指核酸酶输送到严重血友病B型患者的肝细胞中,从而精确地插入基因。该公司还在Hurler和Hunter综合征(两种溶酶体储存疾病)患者的临床试验中使用这些核酸酶。锌指核酸酶被一些人视为老古董,人们认为病毒载体最终将携带Crispr-Cas9进行基因编辑。弗里德曼预测:“在可预见的未来,使用病毒引入功能基因的传统基因治疗方法仍将存在,但基因编辑将成为基因治疗的重要组成部分,用于治疗和预防一系列疾病。”“基因编辑意味着我们不必接受突变基因保持不变。我们可以进入细胞,修正相关基因的拼写。纳尔迪尼对此表示赞同:“Crispr-Cas9和一般的基因编辑技术可以让我们在纠正疾病时达到更高的精确度。”葛兰素史克表示,该公司对基因编辑采取“观察和等待”的态度。
去年夏天,12岁的汉娜·塞姆斯(Hannah Sames)成为接受数万亿带有GAN纠正基因的AAV病毒临床试验的第五个孩子。这项试验仍在继续,植根于格雷实验室对自动驾驶汽车的基础研究。基因疗法将继续为罕见疾病患者带来希望,但它是否能兑现最初的承诺,治愈其他晚期或严重衰弱的疾病,仍有待观察。基因治疗研究人员持谨慎乐观态度。
安东尼·金是一位生活在爱尔兰都柏林的科普作家
参考文献
1 Biffi等,科学, 2013,341, 1233158 (doi:10.1126 / science.1233158)
2 A艾推等,科学, 2013,341, 1233151 (doi:10.1126 / science.1233151)
3 L Lisowski等,自然, 2014,506, 382 (doi:10.1038 / nature12875)









暂无评论