生原体的aducanumab提供减缓病情进展的可能性,但监管机构可能会想要更多的令人信服的证据

2019年10月,意外复活抗体靶向治疗阿尔茨海默氏症,有被遗弃的临床试验前3月。该公司的演讲临床试验在阿尔茨海默氏症(CTAD) 12月初会议因此成为社区的热切期待机会能更好的观察数据,了解生原体的决定。
前台主要是积极的。生原体为美国市场现在将文件批准其amyloid-targeting抗体,aducanumab,但绝不是成功保证。
生原体停止两个三期试验(称为出现并参与)aducanumab后临时分析显示对认知能力没有明显的影响。然后10月,该公司改变了立场,声称实际上出现试验表现出显著的影响,但参与审判没有引发的争论和怀疑。
这种情况是极不寻常的。临时分析2018年12月22日开始,3月结束。在短窗口中,新增了数百名患者接受最高剂量的抗体试验完成。这些患者的数据导致了10月的决定。当他们做了临时的分析,他们没有这些数据,”说保罗•墨菲美国肯塔基大学的神经学家。我不知道这种情况发生任何其他审判。”
降低认知能力下降的第一次审判是归因于这个群体的早些时候开始,服用高剂量长时间——大约一个月。这是很多挥臂和合理化。这并不是说他们是错误的,但它使它冒险,”墨菲说。
CTAD会议上,该公司表明,接受最高剂量的患者一个子集分析时间最长的失败进行审判,每月十剂10毫克/公斤,显示放缓的下降。'如果你看的人接触的时间越长,最高剂量,那么这两个试验有对称的反应,”说丹尼斯·阿兹,一个在波士顿布莱根妇女医院的神经学家,我们。为杰弗里·卡明斯神经学家克利夫兰诊所在拉斯维加斯,我们,这是一个合理的但不是完全令人信服的解释这两种不同的结果。额外的数据可能需要,”他说。
审判专家CTAD承认临时分析经常为了节省药物显然是失败的,但是生原体分析包含只是一半的受试者,和剂量增加一些在审判。的普遍看法是,在未来,对于慢性神经退行性疾病,临时分析应该只停止试验造成伤害,但当陪审团仍然是,”阿兹说。
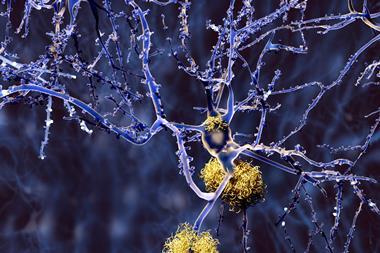
Aducanumab成功清理淀粉样斑块的患者,阿尔茨海默氏症的一个特征。等类似的有前途的抗体礼来公司的solanezumab,在后期实验失败了。”他们的决定(停止试验)可能是在消极的方式也影响了以前其他类似药物的试验失败了,”说大卫·欧烁英国兰卡斯特大学神经退行性疾病研究员。
我不认为他们有足够的直接批准。他们是模棱两可
不过,aducanumab区别于其他失败的抗体。最初由Neurimmune开发在瑞士,它是基于一种抗体从年长的人没有患阿尔茨海默症(老年痴呆),而不是为了目标淀粉样蛋白。它的初步结果有深刻的印象。这是一些最好的数据,我们看到了一种抗体治疗临床疗效,”墨菲说。与其他抗体,它结合β-淀粉样蛋白的聚合形式,而不是单体。
阿兹的主要倡导者淀粉样蛋白级联假说,认为淀粉样斑块是启动疾病。但是,针对淀粉样受到质疑的策略,部分原因是失败的抗体的数量。阿兹反驳说,很多试验都有缺陷,solanezumab审判招聘30%的病人没有斑块。对他来说,高剂量也是至关重要的。“你必须足够高剂量(抗体),150000道尔顿,穿过血脑屏障非常低效,水平0.1到0.3%的血液水平达到神经系统。他建议针对淀粉样现在应该恢复,指出的第一个抗体,bapineuzumab,是管理aducanumab剂量的三十分之一左右。
光在隧道吗?
Aducanumab批准肯定是不安全的。“我不认为他们有足够的直接批准。他们是模棱两可的,”墨菲说。许多机会给它一个比条件批准美国食品和药物管理局(FDA)。墨菲表明10000 - 15000治疗更多的病人在五年内可能最终提供一个答案。这是唯一一个承诺。也许我们应该给它一些有条件的尝试,看看它的工作原理,”他补充道。FDA也可以要求公司重新运行另一个昂贵的3期临床试验。
阿兹说,教训是早期治疗淀粉样蛋白,高剂量。医学历史上这是第一次,我们有什么看起来像一个疾病修饰治疗阿尔茨海默氏症的药物,”他说。在日常生活范围内,最高剂量组患者不出现下降了40%和38%。这是指日常生活能力,使咖啡,或者做一个事务在食品商店。这些都是重要的,”阿兹指出。他支持有条件批准。
其他人也同样乐观。我们终于看到隧道尽头的光为阿尔茨海默氏症,”欧烁说。其他正在进行的试验用类似药物无疑会从中学习。
Aducanumab不是治疗。它不能再生神经元受到炎症,所以不太可能帮助那些先进的疾病。相反,通过清除累积的淀粉样斑块,可能减缓认知能力下降。即便如此,许多希望这将会是第一个阿尔茨海默氏症修改药物,可结合后续目标神经炎症或药物陶蛋白缠结。
FDA召集专家审查小组审查aducanumab试验数据,可能在2020年第三季度。显然该公司更愿意得到监管部门的批准,”墨菲说,“但我不认为FDA将做它的工作,如果批准基于我们所知道的。”
引用
J科洛等,自然,2016,537年50 (DOI:10.1038 / nature19323)











还没有评论